Оглавление:








Предельные углеводороды (алканы или парафины)
- Ограничение углеводородов (алканов или парафинов)’ Повторите из XII§ 1 и 2 (неорганическая химия) глав. Углеводороды-это органические соединения, состоящие из 2 элементов: углерода и водорода. Структура углеводородных молекул метана, этана, пропана и Бутана уже известна(стр. 144-145).
- В молекулах этих соединений полностью насыщены все валентные связи углерода и водорода. Вот почему эти углеводороды не могут быть добавлены. Углеводороды, которые не связывают водород и другие элементы, называются насыщенными углеводородами или алканами.
Простейшим представителем насыщенных углеводородов является метан СН4. Строение молекул метана. Людмила Фирмаль
Молекулярная формула метана СН4, его структурная формула: Н Я н ы н __н 1 алканы-название насыщенного углеводорода по международной номенклатуре. Парафин-исторически сохранившееся название насыщенных углеводородов (latitude Parrum affinis-инертный), по сравнению с другими углеводородами они относительно менее активны.
Поскольку атом углерода обладает большей электроотрицательностью (2.1), чем водород (2.5) (I, стр. 123), в молекулах метана происходит небольшое смешение общих электронных пар с атомами углерода. Поэтому электронная формула метана должна быть выражена следующим образом: м Н: С: Н•• н
Механизм, посредством которого химические связи молекулы метана образуются в результате перекрытия электронного облака, и причина, по которой молекула метана имеет тетраэдрическую структуру, объясняются на стр. 56.Обычно упоминается как гибридизация(рис. 107, стр. 55).При образовании молекул метана 3 s-электронных облака взаимодействуют с 1 p-электроном cloud.
As в результате возникает 4 идентичных формы (гибридизированных) электронных облаков(рис. 108, с. 56). в данном случае эта форма называется гибридизацией sp3, так как в гибридизации участвуют 1 S и 3 p электронов. Серия гомологов метана. Существует большое количество углеводородов, сходных с метаном, то есть гомологов метана («гомологи»по-гречески-похожие), в молекулах которых присутствуют атомы углерода-2, 3, 4 и более.
Каждый последующий углеводород отличается от предыдущего по группе атомов СН2.Например, если вы добавите группу Ch2 к разнице в молекуле метана(группа CH2 называется разницей в гомологе), это будет выглядеть так: Таблица 76.Предельные углеводороды Формула: температура кипения (p°С) нормальное Ра л и фекальное состояние
Условия sn4 метан-161,6 sn3-метил с Н Этан•-88.6 газа с * Н5-этил QH, пропан-42,1 Сж7-пропил С4Н, о Бутане-0. 5Х4Х9-бутил QHI2 пентан+ 36,07 секунды&n, пентил SWNm + 68,7 SWN-гексил 11в гептан + 98.5с7н15-GSPTIL Октановое+ 125.6 жидкости CgH17-го Nonan + 150.7 СГГ, 9-номера-Ил Джодж ^Дин+ 174. 0С102121-Децильные углеводороды ряда метан-этан С2Н6 и так далее. Уравнение для ряда углеводородов метана приведено в таблице 76.
Если число атомов углерода в молекуле принять за π, то состав насыщенного углеводорода можно представить общей формулой Электронная и пространственная структура насыщенных углеводородов. Электронная и пространственная структура других представителей насыщенных углеводородов аналогична структуре молекул метана.
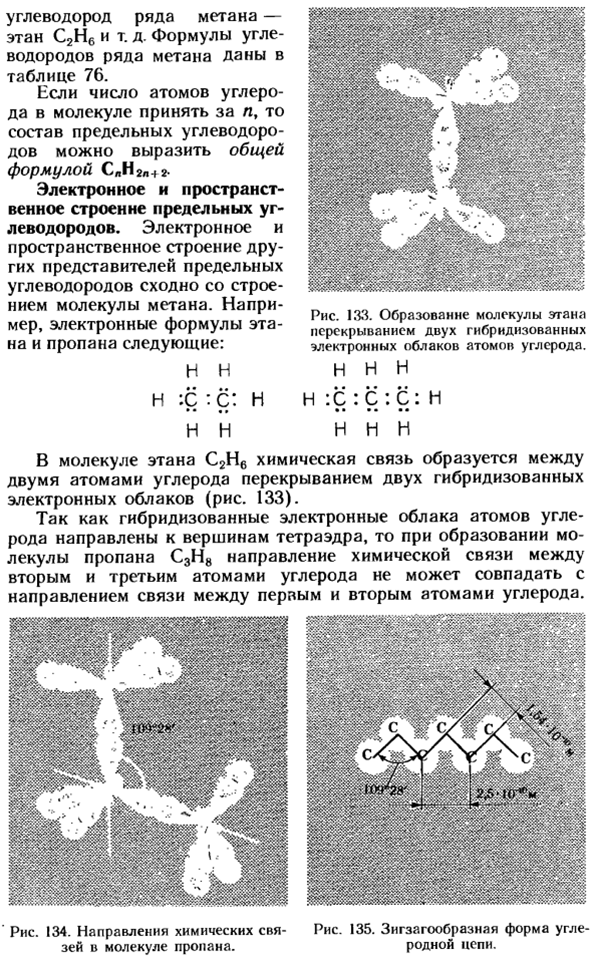
Например, электронные формулы этана и пропана: И Н Х: Ц: Ч: Ч: Ч•••• Н. Н. Н. В молекулы этана С2Н6 химическая связь образуется между 2 атомами углерода путем перекрытия 2 гибридных электронных облаков(рис. 133). Поскольку гибридное электронное облако атома углерода направлено к вершине тетраэдра, то при образовании молекулы пропана C3H8 направление химической связи между 2-м и 3-м атомами углерода не может совпадать с направлением связи между 1-м и 2-м атомами углерода.
Рисунок 134.Направление химической связи. 135.Зигзагообразная форма угля в молекулах пропана. Родная цепочка. ■■ — в Рисунок 133.Образование молекул этана происходит за счет перекрытия 2 гибридных электронных облаков атомов углерода. Нин Н: С: С: С: С: я олова Образуется угол 109°28 ′ (рис. 134). Такой же угол существует между 4-м, 5-м и другими атомами углерода.
Именно поэтому углеродная цепь принимает зигзагообразную форму (рис. 135), но при отображении формулы эти углы не отображаются(например, CH3 — CH2-CH3). Вопрос 1-5 (стр. 154) для ответа. Гетеросексуальность и номенклатура. Поскольку существует много углеводородов (в том числе ограниченных углеводородов), специальная номенклатура 1 была принята Организацией Объединенных Наций 1 теоретических и прикладных Chemistry.
To используя его, нужно познакомиться с понятием «радикал» и явлениями изомерии. В таблице 76 приведены первые 10 уравнений насыщенных углеводородов. Если вы мысленно вычтете из Формулы 1 атом водорода, то получите группу атомов, называемых радикалами. Название радикала образовано от названия соответствующего углеводорода путем изменения суффикса-Ан на-Ил.
Пример: метил CH3—, этил CH3-CH2 -, пропил CH3-CH2 -, бутил CH3-CH2-CH2-и др. Разнообразие углеводородов связано с изомеризацией явления (с. 145) объясняется тем, что с увеличением числа атомов углерода в молекуле число изомеров увеличивается sharply. So например, существуют 2 Бутана, 3 пентана, 5 гексана, декан C10H22, 75.
Предполагается, что во всех молекулах атомы водорода замещаются различными радикалами, чтобы создать название разветвленной цепи насыщенной hydrocarbon. To определите название этого углеводорода, придерживайтесь определенного порядка. 1.In в Формуле, выделите самую длинную углеродную цепь, пронумеровав символы атомов углерода в ней, от конца цепи с близкой ветвью. Три 1.
Международный союз чистой и прикладной химии, IUPAC (UPAC). 2.Назовите радикалы(начиная с самых простых), используя числа, указывающие их расположение в пронумерованных атомах углерода. Если в одном атоме углерода есть 2 одинаковых радикала, то число повторяется 2 раза. Число идентичных радикалов обозначается греческими цифрами (Ди-два, три-три, тетра-четыре и др.) (см. формулу первого абзаца). а)2-метил… Б)3-метил… в) 2,2-диметил… д)2,3-диметил…
- 3.Полное название этого углеводорода задается числом атомов углерода в нумерованной цепи: а)2-Метилпентан b)3-метилпентан c)2,2-диметилбутан g) 2,3-диметилбутан Вопрос 6-9 (стр. 154-155). Быть на природе. Простейший представитель насыщенных углеводородов-метан — образуется естественным путем в результате разложения остатков растений и животных организмов, не имеющих доступа к воздуху.
Это объясняет появление пузырьков во влажной воде. Метан добывается из угольных пластов и может накапливаться в шахтах. Основную часть природного газа (80-97%) составляет метан, который также содержится в Газе, выделяющемся при добыче нефти. Природный газ и нефтяной газ включают Этан C2H6, пропан C3H8, Бутан C4H, 0 и др. ■ Reception.
В нефти содержатся насыщенные углеводороды газов, жидкостей и твердых веществ. Людмила Фирмаль
In в лаборатории метан получают нагреванием ацетата ch3coona натрия с твердым гидроксидом натрия. CH3COONa + NaOH X CH4t + Na2C03 Этан и другие насыщенные углеводороды с более длинными углеродными цепями получают взаимодействием галогенированных насыщенных углеводородов с металлическим натрием. Chj-jl NGJ «Т + К1! — См,+ 2NaI sn3-Fi Интернет _ _ _ на; 3 3 Йод-метан этан Первым, кто осуществил эту реакцию в 1870 году, был французский химик А. Вюрцреакт.
Смеси различных насыщенных углеводородов получают нагреванием угля в высокотемпературной атмосфере водорода под высоким давлением. Эта смесь используется как жидкое топливо для двигателя, а также как ценное сырье для органического синтеза. Ответьте на вопросы 10 и 11 (стр. 155). Физические характеристики. Метан-газ без цвета и запаха, почти в 2 раза легче воздуха, слабо растворим в воде.
В нормальных условиях этан, пропан, бутан — это газ от пентана до пентадекана, жидкость и следующий гомолог-твердое вещество (таблица 76).Пропан и Бутан под давлением находятся в жидком состоянии и при комнатной температуре. Как видно из таблицы, при увеличении относительной молекулярной массы насыщенного углеводорода его температура кипения и плавления естественным образом возрастает.
Химическое свойство. 1.Наиболее характерной реакцией насыщенных углеводородов является замещение reaction. So например, при освещении метан вступает в реакцию с хлором (при сильном освещении может произойти взрыв). И Н Я Г — — — — — — Т Я Н-tH-tH+ SI-CI-Н-С-С1+ HCL Мне.———- Я И затем Хлорметан, или метилхлорид И Н Н-С-С1+НС1 ки Дихлорметан, или метиленхлорид _ Ди-ч- [ч _ + _ цлр-СНБА-с-ки + HCI с собой Трихлорметан, или хлор В1. I г—- 1 т и а-Си-Си — Си-Си-УБ Ки-ки Четыреххлористый углерод. Или четыреххлористый углерод
Дело в том, что реакция насыщенных углеводородов и галогенов является более сложной. Когда он поглощает световую энергию, молекулы хлора разлагаются на атомы. CL 4″!Улыбка: -: КТ — + — КР Атомы хлора с 1 неспаренным электроном обладают высокой химической активностью. При их столкновении с молекулой метана происходит реакция, в результате которой образуется химически очень активный метильный радикал. Н_________ Н H: с > Р +•&:!- H: с — + Н: ки: * h________••__я•••• Н. н. Н.
Метильный радикал Его активность также объясняется наличием неспаренных электронов (неиспользуемая валентность). Частицы, которые имеют неспаренные электроны и поэтому имеют неиспользуемые вакансии, называются свободными радикалами. Из вышесказанного видно, что реакция метана и хлора протекает по свободно-радикальному механизму. Метильный радикал (который существует только в течение 1 тысячи минут) вступает в реакцию с другой молекулой хлора, разрывает связи между атомами в ней и разрывает свободные атомы хлора с неспаренными электронами и электронами.
Таким образом, создаются новые химически активные частицы, вызывающие дальнейшие превращения. Реакция, которая приводит к цепочке последовательных преобразований, называется цепной реакцией. В развитии теории цепных реакций Нобелевский лауреат н. н. Семенов сыграл важную роль. Этан, пропан, и другие насыщенные углеводороды также вступают в реакцию с хлором. Полученное вещество называется галогенированием. Многие из них используются в качестве растворителей.
Насыщенные углеводороды не обесцвечивают бромистую воду при комнатной температуре, поскольку они вступают в реакцию с галогенами только при высоких температурах или под воздействием света. 2.Все насыщенные углеводороды производят и сжигают монооксид углерода (IV) и воду. Метан-это бесцветное пламя, которое горит и выделяет тепло: CH4 + 202 = CO2 + 2NgO + 880 кДж Смесь метана и кислорода (объемное соотношение 1: 2) или воздуха(1: 10) взрывается и сгорает при горении.
Взрывы могут происходить и в других объемных соотношениях насыщенных углеводородов и воздушных смесей. Поэтому смеси метана, этана, пропана, бутана и воздуха очень опасны. Они могут образовываться в угольных шахтах, в котельных заводов, в цехах, в жилых домах. 3.При сильном нагреве (более 1000°С), который не пропускает воздух, происходит разложение насыщенных углеводородов. ИРЛ СН4 ^ с + 2Н2 При нагревании метана до более высокой температуры(1500°C) реакция протекает следующим образом: / Г. Г)Л«Г 2CH4 —C = C-H + 3H2(С. сто семьдесят девять) Ацетилен.
Эта реакция дегидрирования (расщепление водорода) имеет большое промышленное значение, как и дегидрирование других насыщенных углеводородов, в том числе этана C2H6. Н3С-СН3 — — — = СН2+Н2 Этан этилен Этилен широко используется в производстве спирта, синтетического каучука и других веществ. 4.Под действием катализаторов и при нагревании углеводороды нормальной структуры подвергаются реакциям изомеризации и превращаются в разветвленные углеводороды. Ки и3-СН2-СН2-СН2-CI13 СН3-СН-СН2-сна СВ. И C H s 2-Метилбутан Ответ на вопрос 12-16 (стр. 155).Решите задачу 1-3(стр. 156).
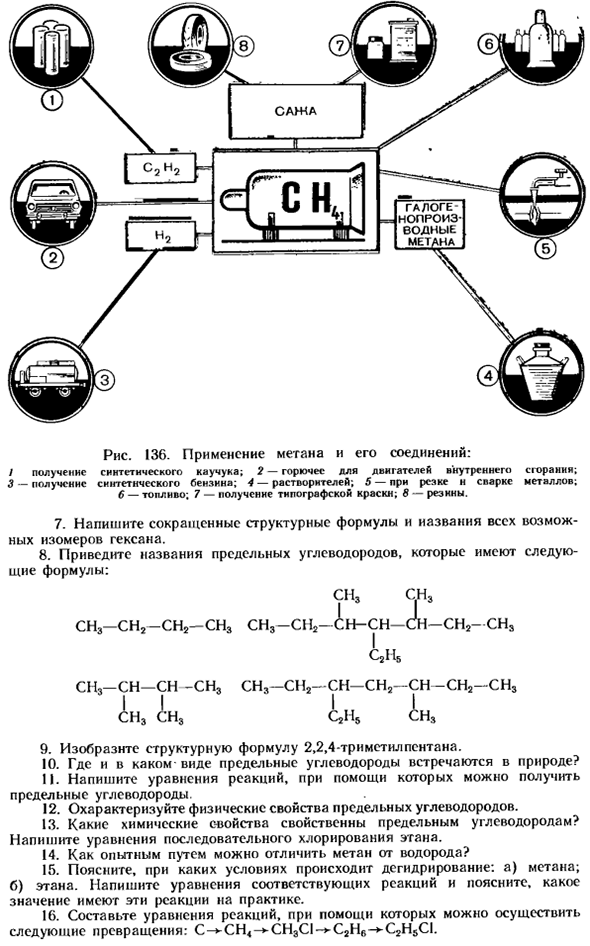
Использование метана весьма разнообразно (рис. 136). в виде природного газа метан широко используется в качестве топлива. Большое практическое значение имеют производные хлора метана. Например, хлорметан CH3C1-это легко сжижаемый газ, который поглощает большое количество тепла при последующем испарении. Поэтому он используется в холодильных установках. Дихлорметан CH2C12, трихлорметан (хлороформ) CHC13 и четыреххлористый углерод (четыреххлористый углерод) CC14 являются жидкостями, используемыми в качестве растворителей.
В медицине применяют трихлорметан (хлороформ) и трииодометан (йодоформ).Четыреххлористый углерод при испарении используется для тушения пожаров, так как образует тяжелый дым, который изолирует горящие объекты от проникновения кислорода атмосферы. Ответьте на вопрос 17 и выполните упражнение 18 (стр. 156).Задача 4-5 (стр. 156).О * I. Как расположены электроны на энергетических уровнях и подуровнях атомов углерода?
Почему можно связать форму электронного облака с 2 «- электронами » в атоме углерода? 2.Электронная формула метана и этана является drawn. By накладывая соответствующие электронные облака, мы объясняем, как образуются химические связи в молекулах этих веществ. 3.Докажите, что метан является тетраэдрической формой молекулярной структуры. Как этот экспериментальный факт объясняет морфологию электронных облаков и принцип их гибридизации?
4.Какие соединения называются насыщенными углеводородами? Пожалуйста, приведите пример. 5.Что такое вещество, называемое гомологом? Пожалуйста, приведите пример. 6.Что называется радикальным? Напишите формулу и название радикалов, которые можно оценить по первым 6 насыщенным углеводородам. Рисунок 136.Использование метана и его соединений: Синтетический каучук доступен. 2-топливо для двигателей внутреннего сгорания; 3-Производство синтетического бензина; 4-растворитель; 5-при резке и сварке металлов; 6-топливо;
7-получение печатной краски. 8-резина. 7.Напишите сокращенную структурную формулу и название всех возможных изомеров гексана. 8.Name насыщенный углеводород с формулой: CH3 CH3-CI L-CH-CH-CH-i СН3-СН2-СН2-СН3 СН3-СН2-СН2-СН3 С. Н. СН3-СН-СН — СН3-СН3-СН3-СН2-СН2 — СН-СН2-СН3! Н3£Н3 qh5 и — C2H5CI. 17.In для каких практических целей используются насыщенные углеводороды? 18.Составьте сводку ответов, характеризующих метан, этан, пропан(I, стр. 43). Яннопулос. Вычислите количество раз, когда пропан легче или тяжелее воздуха.
Какова масса пропана в нормальных условиях? 2.Количество монооксида углерода (IV), образующегося по объему при сгорании: а) 5 м3 этана. 6) Этан 5 кг (н. э.)? 3.Какое количество кислорода и воздуха необходимо для сжигания Бутана 67,2 м3? 4. Рассчитайте количество хлора, необходимое для получения 202 г хлорметана в литрах и граммах. 5. Сколько воздуха требуется для сжигания 90% метана, 5% этана, 3% окиси углерода (IV) и 2% азота с объемной долей газа 50 м3?
Смотрите также:
| Значение теории строения органических веществ А. М. Бутлерова | Циклопарафины (циклоалканы) |
| Электронная природа химических связей в органических соединениях | Пниктогениды |
