Оглавление:





Принцип возрастания энтропии. Обратимые и необратимые процессы.
- Принцип роста энтропии Обратимые и необратимые процессы Рассмотрим систему, в которой происходит изменение локальной сети. Это изменение называется обратимым, если STR может быть изменен. a) переменная, характеризующая состояние системы, передает один и тот же набор значений в обратном порядке. б)температура окружающей среды системы с окружающей средой теплая, а вещества, м, и работа имеют противоположный знак и происходят в обратном направлении order.
So например, если в тракте LAN(рис. 3.4) система получает определенное количество тепла Q, то необходимо дать такое же количество тепла в обратном тракте SVL. It важно помнить, что независимо от того, насколько близки точки A, B и C друг к другу, это должно оставаться верным. Все изменения, не соответствующие этим 2 условиям, называются необратимыми.
Ни один из процессов, происходящих в природе, не является обратимым. Все процессы необратимы, но реальный процесс можно считать сколь угодно обратимым и близким. Поэтому обратимый процесс необходимо рассматривать как идеальный случай ограничения, в котором к реальному процессу можно подойти при соответствующих условиях. Например, рассмотрим широкую {/- образную трубку, заполненную water.
In в этой трубке уровень воды в одном локте выше, чем в другом. Этот уровень колена падает и проходит через положение равновесия. Затем уровень воды в другом колене поднимается примерно на такую же высоту. Затем происходит обратный процесс. Если трение и вязкость можно свести к нулю, то на пределе можно получить обратимые изменения. В качестве 2-го примера рассмотрим обратимую диссоциацию газа.
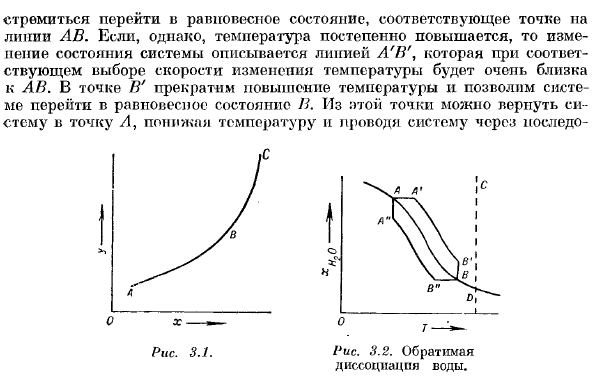
- Водяной пар в закрытом сосуде 1200°C диссоциирует, но равновесие устанавливается При этой температуре и при заданном давлении молярная доля воды в газовой смеси а-НЗО имеет определенное значение. Это равновесное состояние соответствует точке а на рисунке. 3.2.Если вы немного поднимете температуру и переместите ее в точку L\, система выйдет из состояния равновесия. Число диссоциирующих молекул воды увеличивается, и система Стремитесь к переходу в состояние равновесия, соответствующее точкам на лекарственной линии.
Однако если температура повышается постепенно, то изменение состояния системы будет описываться линией L’1U, и если скорость изменения температуры выбрана правильно, то она будет очень близка к AN. Остановите повышение температуры в точке H и приведите систему в равновесное состояние I. Из этой точки верните систему в точку A и понизьте температуру, чтобы система прошла через последнюю. Рисунок 3.1. Рисунок 3.2
Обратимая диссоциация воды. Людмила Фирмаль
Состояние, соответствующее строке B»A». в пути B» A «система не проходит через то же состояние, что и путь A’B’.Таким образом, процесс A’b ’»не может быть отменен. Однако, правильно контролируя изменение температуры, температура всегда может быть сколь угодно близка к равновесию state. At в то же время равновесное значение нельзя точно приапать. В противном случае реакция будет stop. In таким образом, A’B ’может быть произвольно близко к AN. Таким образом, АВ можно рассматривать как идеализацию актуального process.
It говорят, что изменение равновесия является обратимым изменением, и действительный процесс будет максимально приближен, если его осуществить slowly. So, равновесный процесс формируется совокупностью равновесных состояний system. In химия, равновесный процесс-это темная реакция, которую можно считать обратимым явлением. Как видно из приведенных примеров, все реальные явления необратимы. Обратимый процесс может быть описан только как гипотетический идеализированный процесс. Однако есть много явлений, которые не могут быть идеализированы в этом way.
An важным достижением термодинамики последних лет является распространение необратимых процессов в природе. Мы рассмотрим лишь несколько примеров таких явлений. Все реальные химические реакции и все изменения, происходящие с конечной скоростью, необратимы. Например, рассмотрим систему состояний, соответствующую точке C на рисунке 1. 3.2, и предположим, что температура системы поддерживается постоянной. Система проходит через состояние, представленное точками сегмента CD.
Это связано с тем, что в каждой точке этого отрезка скорость диссоциации молекул воды больше скорости их образования. Изменение C — + D не может быть связано с идеальным обратимым процессом. Существуют также необратимые процессы, такие как выравнивание температуры в системе, механическое разрушение, вязкое течение жидкости, эффект челюсти Ля и diffusion. To идеализируя вышеописанный процесс, необходимо исключить все такие явления, которые очень часто совершенно невозможны.
Этот процесс не может быть выполнен в обратном порядке вдоль DC. Людмила Фирмаль
Смотрите также:
| Уравнение Клаузиуса и Кирхгофа | Формулировка второго закона термодинамики: изменения энтропии и возрастание энтропии |
| Теплота реакции и энтальпия | Термодинамические потенциалы |
