Оглавление:




Уравнение Клаузиуса и Кирхгофа
- Уравнение Клаузиуса и Кирхгофа В предыдущем параграфе мы установили зависимость между коэффициентом калорийности Su, b, um, v>и коэффициентом CPt b, hr, i, hr, r>.Здесь мы покажем, что коэффициенты каждой из этих групп просто взаимосвязаны. Рассмотрим внутреннюю энергию V как функцию T, V и получим тождество 02and_ ЦОР)Вт диджей _ д * И Д d4J ДГ — Компания WD \ = д \ дв ’- dTdb = 1)1 ДТ’ * 1 (ДУ \ dT 1 [WJ д / Ди \ Н1 ДТГ D (Ди Г Л. В. И… CHL-R) dT dSUL Д1 / ый, в- » ДТ УЛ. 1. (2.29) dVdT dTdV, следовательно, из Формулы (2.8) (dSUL \ I ДВ)Т д(ду Дт \ 01 T, V
Эти уравнения известны как уравнения Клаузиуса, но второе уравнение, связывающее изменение теплоемкости и температурного коэффициента теплоты реакции, также называется уравнением Кирхгофа. Последнее уравнение, выражающее влияние объема на теплоту реакции, было впервые получено додондом. То же самое можно сделать для переменных T, p и|.Затем получите 2-й праймер уравнения Клаузиуса. (СТОСН \ г ( г.* + Уе \ др)т ДТ л} пл 9 9 (d«) -; * ’ t, V to’TR (2.30) 9 (БТ + г) 01 ]• J, т, п dt. — (- ) = Г д \ д J Т> П Л 2-я часть этих уравнений иногда называется 2-й Кирхгоф equation. In кроме того, поскольку CPi $является функцией состояния системы、
Эти уравнения известны как уравнения Клаузиуса, но второе уравнение, связывающее изменение теплоемкости и температурного коэффициента теплоты реакции, также называется уравнением Кирхгофа Людмила Фирмаль
Где cVt i-частичная молярная теплоемкость, определенная в (2.18). Таким образом, 2-е уравнение Кирхгофа можно переписать следующим образом: Используя эту формулу, можно рассчитать теплоту реакции при любой температуре, если известно это значение при определенной температуре, а также частичную молярную теплоемкость компонентов, участвующих в реакции. reaction. It обычно необходимо считать, что частичная молярная теплоемкость равна соответствующей молярной теплоемкости в чистом состоянии. Для газона это предположение очень верно.
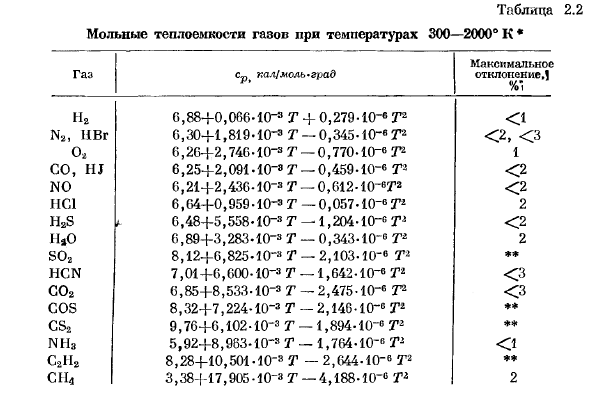
- Температурную зависимость теплоемкости газа удобно выразить в виде степенного ряда. с-п = а + вт + ст2 + …、 Обычно достаточно высокая температура дает удовлетворительный результат (см. главу X,§ 3).Внутри таблицы. Приведена формула, соответствующая некоторым простым соединениям, применимым в 2.2, температурный диапазон 300-3000°К. Таблица 2. 2 Молярная теплоемкость газа при температуре 300-2000°к*
Максимальный газ КПП кал / моль град отклонение.1. Н2 6.88 +0.066.10 — ®Т+ 0.279-10-6 Т2 < 1 На Евр. 6.30+ 1.819-Ю-3 Г-0.345- \ 0 — * Т2 <2,<3 О. 6.26 + 2.746.10-8 г −0.770.1 () — е Т1 1 HJ в 6.25 + 2.091 * ю — «т-0.459-10-6 Т2 <2 Вып.6..21 + 2.436-10-*-0.612- lO-6 ′ / 12 < 2 НС1. 6.64 + 0.959-10-3 т.-0.057-10- 6Tl 2 H2S ’6.48 + 5.558-10 3 т.-1.204-10-6 T * <2 ТНТ 6.89 + 3.283.10- * Т.-0.343-10-6 Т. 2. С02 8.12 + 6.825 „У“ 3 Т-2.103 * 10 » ®Т * ** HCN. 7.01 + 6.600•10 ″ 3 Т-1.642-10 Тл <3 С02 6.85 + 8.533-С-3 Т-2.475-10 ″ 6 3-2 <3 ПОТОМУ ЧТО. 8.32 + 7.224-10 3 Т.-2.146-10-6 ТЗ. ** ЧСА. 9.76 + 6.102-10 3 т.-1.894-10〜 е Т2 * + NН3 5.92 + 8.983-10_s Т-1.764-10-6 Т2 < 1 C21I2. 8.28 + 10.501-10 3 Т.-2.644-10- * T2 + * CII4 3.38 — [-17,905. 10-е г—4,188-10- ® T2 2 пример.
Подумайте еще раз о реакции синтеза аммиака N2 + ZN2 — — — 2nu * температура реакции при 25°C /(Вт \ Я -)= −22080 кал(см. таблицу 8.1). GL в / 208.1 Определить теплоту реакции при 932°К. Будем считать, что парциальная молярная теплоемкость соединения в газовой смеси равна соответствующей молярной плотности в чистом состоянии, и воспользуемся формулой, приведенной в таблице. 2.2, находим: Р? ОД \ =-15.10 + 15.009-10- * T-4.020-10 ″ e7z =-(- ДТ \ J и ТГ Если вы интегрируете от 0 до T, вы получите 1 (ду / Д1)r0L ам «= БУГАГА-15.10 Т+ 15.900-10-3 тг / 2-4. 020-10〜Е Т * / 3» = = / ОО.1-15-10т+ 7.954-10〜с-тг.-1.34-10〜 ° Т3. (2.33) Я/. T = 298°K при 1 = 22 080 калорий (2,33) при подстановке этого значения константа компиляции/к. II будет найден.
Эта константа является −18250 коэф. Поэтому теплота реакции при других температурах 2 составляет、 Для T = 932°K вычислите\ dN / d) R i = −26500 cal. It соответствует определению прямой калориметрии Gaber 3 (-2G320±200 кал).
Эта константа является −18250 коэф. Людмила Фирмаль
Смотрите также:
