Оглавление:
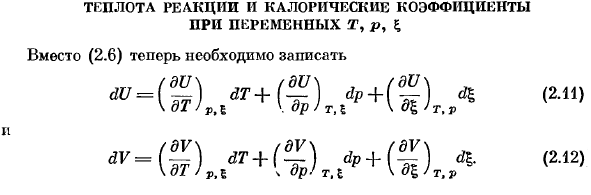




Теплота реакции и калорические коэффициенты при переменных т, р, £
- Различные T, P,£термальная реакция и коэффициент жары Вместо (2.6), вам нужно написать. — 12121. V не является более независимой переменной, поэтому нам нужна 2-я связь здесь. Когда я назначаю (2.11) и (2.12) на (2.3)、 | йд = с ^ ДТ + ХТ, ТДП + час, Prfj,| (2.13) Передо мной фдв / дю rl (дю (2.14) дл. дл> т, в фдв \ =Средняя з; rl Р =время tl. — т, п
Для выбора такой переменной удобно использовать функцию под названием энтальпия. H = U + pV. (2.1 //) Применяя эту функцию, уравнение приобретает более простую форму. Первый закон термодинамики можно переписать в виде: йд = Вт-ПДВ-ВДП + ПДВ = Dн-ВДП (2.15) Откуда?
Величины CPi hT, t и hT, P являются коэффициентами калорийности переменных T, p. Людмила Фирмаль
Это выражение должно быть таким же, как (2.13)… 1. — В ■ ХТ, п =(Д4) (2.17) г(дх ^ В Д%/ Г> П Смысл этой 2-й строки калорического коэффициента совершенно однозначен. CPt i равен количеству тепла, которое должно подаваться в систему для повышения температуры при постоянном давлении и композиции на 1 градус.
Эта величина называется теплоемкостью системы при постоянном давлении и составе, и является широко распространенной характеристикой. Основано на теореме Эйлера.、 (2.18) { \В Представляет собой частичную молярную теплоемкость компонента i в смеси при постоянном давлении;
- Коэффициент Hm,\обычно отрицательный, и (- hT, s)равен количеству тепла, рассчитанному на единицу повышения давления, которое должно быть удалено из системы для поддержания постоянной температуры при сжатии с постоянным составом.
Необходимо изменять давление при постоянном T и|или Необходимо изменить объем, это количество должно быть связано с теплотой расширения 1 м. соотношение kt, I и 1m, r установлено в§. Оттуда мы используем уравнение состояния, pV = pIT、 tiRJ1. hT, i — — — — = — V (идеальный газ). (2.19) kt, p-теплота реакции при постоянных T и p. то есть количество теплоты, которое поглощает система при постоянных T и p, эквивалентно 1.
Эта величина называется скрытой теплотой изменения давления при постоянной температуре и составе. Людмила Фирмаль
Смотрите также:
| Формулировка принципа сохранения энергии | Соотношения между калорическими коэффициентами |
| Теплота реакции и калорические коэффициенты при переменных т, г, е, | Уравнение Клаузиуса и Кирхгофа |
