Оглавление:





Расчет кинематического коэффициента диффузии в растворах электролитов.
Расчет кинематического коэффициента диффузии в растворах электролитов. Диффузия растворенных и ионизированных электролитов состоит из диффузии катионов и анионов. Этот процесс количественно объясняется Перне (1888).Он, согласно теории Аррениуса, исследовал слабые электролиты, которые почти полностью распадаются на ионы в очень разбавленном растворе. Согласно упрощенной идее, подвижность ионов в этих условиях не зависит от концентрации электролитов. Абсолютная скорость ионов это скорость их движения в электрическом поле с градиентом потенциала, равным 1.
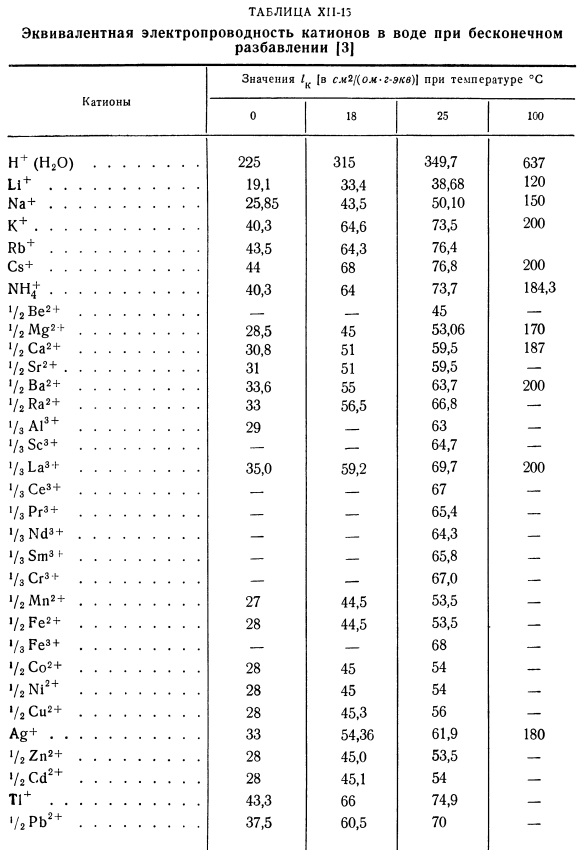
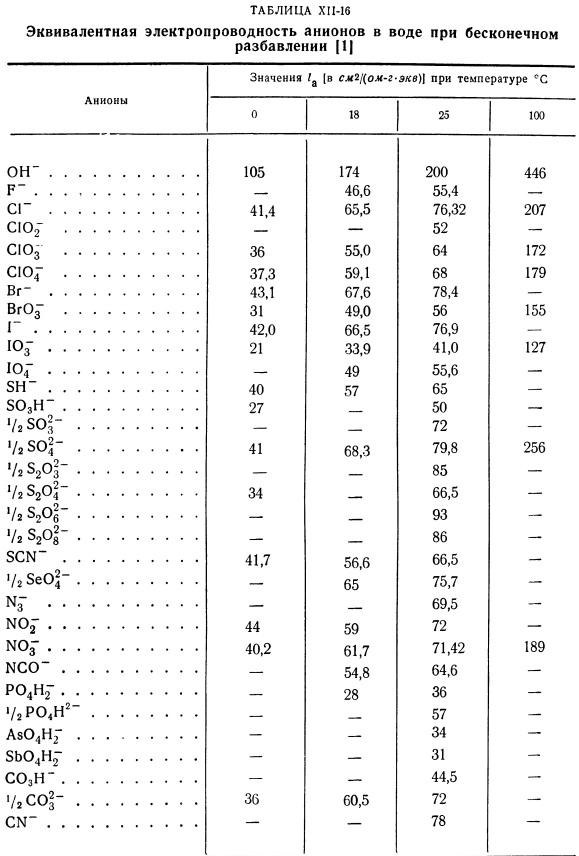
Обычно абсолютная скорость Иона составляет см2!(С-в).Подвижность (или ионная проводимость) пропорциональна И. Эквивалентная электропроводность/ c и / a анионов зависит от подвижности катиона. 1к-Рик\ у =(привет-50) Где P-постоянная Фарадея, равная 96 500 coul / g-eq. Предел эквивалентной проводимости ионов а / а равен эквивалентной проводимости растворов с бесконечно большими разбавлениями. Это значение обычно находится в см2 /(ом•г-эквалайзер)или Но… см2 (в!) см) (г-эквалайзер / см *)* + ^ 1 2JAT(X11-51) Г2. 2KT (HI-52) о *〜( «в Или Т. Т. Т.
Используя уравнение Нернста для расчета кинематического коэффициента диффузии очень разбавленного раствора, можно добиться хороших результатов. Людмила Фирмаль
- Газовая постоянная равна −8.316 Дж /(град•моль)\ T-температура,°К. / k, / a-предельная эквивалентная проводимость катионов и анионов; Р-постоянная Фарадея. Если Ион не одновалентен, а валентность катиона равна gk и Nong, то в уравнении Нернста вместо коэффициента 2 Требуется формула ( -+ -).Эквивалентное значение Электропроводность ионов при бесконечно большом разбавлении показана в таблице. КП-15 и КП-16. Например, подвижность хлорид-ионов калия выглядит следующим образом: «„+=6,75 * 10 “ 4 см2!Считанные секунды. И = 6,85•10-4 см21 секунды КИ.
Подставляя эти значения в Формулу (КП-51), находим кинематический коэффициент диффузии при 18°С: 0 / $°с = 1,70 * \ 0-5см / sen. It было найдено экспериментально/) » * > c = 1 * 69 * 10 5 см2 / Сен. Уравнения Нернста(КП-51) и (КП-52) также пригодны для расчета температурной зависимости коэффициента диффузии. Если в таблице. Хп-15 и хп-16 не имеют значений»и/» при температуре расчета коэффициента диффузии Og. In в этом случае Рид и Шервуд [2]рассчитали ом * с при температуре 25°С и пересчитали по формуле: °М = S-Щ7<Х|| −53> Где tg-вязкость воды при температуре 7’0K, ccd.
- Величина кинетического коэффициента диффузии электролита зависит от концентрации(рис. СР-2). очень трудно точно определить концентрационную зависимость коэффициента диффузии, а известное, теоретически обоснованное уравнение не подходит для технических расчетов. s» 2 н. в пределах концентрации до. Можно воспользоваться полуэмпирической формулой, предложенной Гордоном [7]. 0 = 0°. B-(1 + m 4^) (XH-54) Где о-коэффициент кинематической диффузии электролита в Т-молярном растворе, см2!Считанные секунды.
Бесконечно низкая концентрация, кинематический коэффициент диффузии электролита в растворе см2 / с; V-объем раствора, см3. V, парциальный молярный объем растворителя, см3 / моль; xx-молярное число растворителя в растворе объемом V см3. Т-молярная концентрация раствора. C-Кинематическая вязкость раствора pz. коэффициент динамической вязкости U-растворителя, ПЗ; V-среднее значение коэффициента молярной активности. (Согласно таблице). Согласно уравнению (КП-54), кинематический коэффициент диффузии может быть рассчитан достаточно точно, но трудно использовать формулу Гордона, так как нет соответствующих данных (в частности Y \и y).
По этой же причине еще сложнее использовать точно теоретически обоснованные уравнения, предложенные разными авторами. Обзоры исследований этих авторов были проведены Лидом и Шервудом. Людмила Фирмаль
- Пример CI-11.Определить кинетический коэффициент диффузии хлорида лития 0 в очень разбавленном водном растворе при температуре 25°С(Г = 298.2°К). Решение 2 ст. По формуле (HP-52): 0°= 1. Таблица по S-15 для HP-15 * / k » 38.68; * «СГ мне хп-16 = 76.32. с.= 2■■8.316 298.2 =、37。СХ-5 порыв Найденные значения можно сравнить с экспериментальными значениями. Согласно таблице, температура при 0,01 Н составляет 9°С. 1ds1 раствор 0 = 0,757 см2 / сут. Таким образом, экспериментальное значение коэффициента составляет 0 = 0,876 * 10’5 см2!Второй. По формуле (XN-53): Диффузный CP-8: 0 = 0 25 * С 273.2-b 9 334d (Жб8 + 76ж) 96 5002 Вязкость воды при температуре 9°с rv = 1,346 cps.
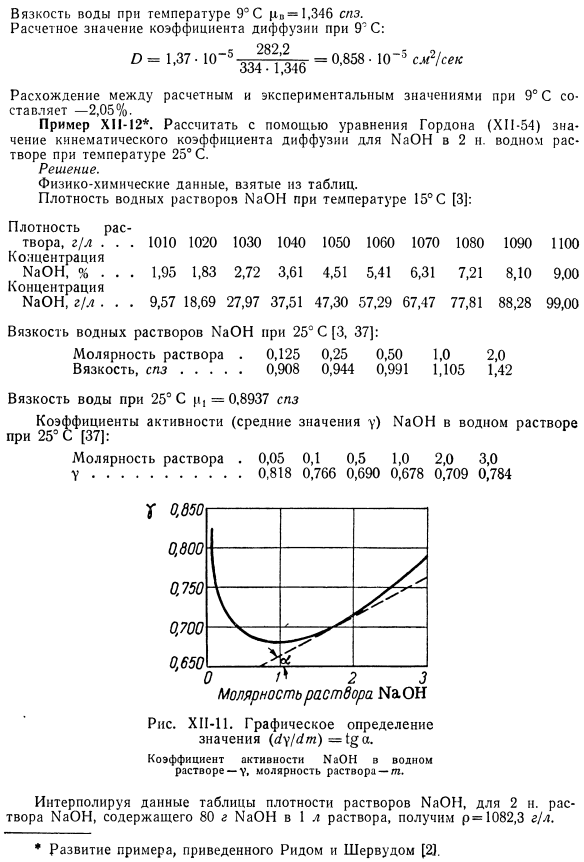
Расчет коэффициента диффузии при 9 * C: О. 1.37•10-*нет.= 0,858•10-5 см Расхождение между расчетными и экспериментальными значениями при 9°С составляет −2,05%. Пример HP-12 *. Используя уравнение Гордона(КП-54), рассчитайте значение кинематического коэффициента диффузии NaOH при 2 Н водного раствора при температуре 25°С Решение. Физико-химические данные получены из таблицы. Плотность водного раствора N9014 при температуре 15°C(3): Рисунок XH-11.Графическое определение значения (4y / 4t)=1§a. Коэффициент активности NaOH в водном растворе-y, молярная концентрация раствора.
Смотрите также:
Методические указания по гидравлике
Возможно эти страницы вам будут полезны:
