Оглавление:


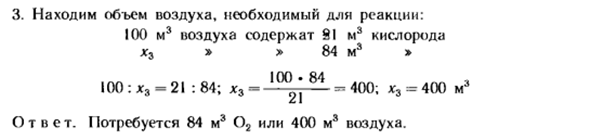

Расчеты, связанные с применением закона Авогадро
- Расчеты, связанные с применением метода Авогадро I. найти плотность и относительную плотность по химической формуле данного газа. Проблема. Рассчитайте плотность и относительную плотность монооксида углерода (IV) из водорода, метана и воздуха.
- Решение. I) вычислить молярную массу газа: M (CO») −44 г / моль; L *(H2) — 2 г / моль; M (CH4)= 16 г / моль; M воздуха= 29 г / моль; 2) вычислить плотность монооксида углерода (IV). Q — 1.96; 0 (CO2) −1.96 г / см3; ясно «- ^ — «= 2.75; D»,= C = 22; Ответ. Плотность монооксида углерода (IV) at. In масса Il) равна 1,96 г / см8, He, 22. ДК » 4-2. 75; Д ^-1.5.
2.Химическая формула и масса конкретного газа (n. At. расчет объема газа по a). Проблема. Людмила Фирмаль
«Каково количество кислорода в 48 г?»Решение. I) вычислить молярную массу кислорода. М (02) −32 г / моль 2) объем приходится на 48 г кислорода: 32 г () 2 занимает объем 22,4 л 48 и ор 32:48 = 22.4:х; х = » 48 * Ф2. 4 = 33,6; х = 33,6 л. ответ. 48 g 02 занимает объем 33,6 литра. 3.Расчет массы по химической формуле и объема конкретного газа1(n. At. it это не так.
Проблема. Рассчитайте массу смеси газов, состоящей из 5,6 м3 метана и 2,24 м3 монооксида углерода (II). Решение. I) вычислить молярную массу метана и монооксида углерода(II): M (CH4)= 16 г / моль; M (CO)= » 28 г / моль 2) определить массу метана на уровне 5,6 м3. Масса 22,4 м3 СН4 составляет 16 кг » х 5,6 м3 СН4″ 、 22.4: 5.6 = 16:*,; x,= M ^-= 4; x = 4 кг
- 3) определить массу монооксида углерода 2,24 м3 (I): Масса 22,4 м3 со составляет 28 кг «2», масса 4 м3 ″ Х2 22.4: 2.24 = 28: x2; x2 = ^ ^ — 2.8; x2 = 2.8 кг 4) Найти общую массу смешанного газа: 4 кг + 2,8 кг = 6,8 кг ответ. Общая масса смешанного газа составляет 6,8 кг. 4.Вычисление массы вещества по уравнению химических реакций, в которых участвуют или образуются газы.
Проблема. Сколько кислорода и воздуха необходимо для сжигания 0,25% или 25% углерода (II), оксида объемом 224 м3 с негорючими примесями по объему? Решение. 1) рассчитайте количество чистого оксида углерода (II), содержащегося в смеси. Смесь 100 м3 содержит 75 м3 смеси 224 м3 ″ х、 294.
Семьдесят четыре 100: 224 75: x ;; x, — ^ 1 ^ .- 168; х= 168 м3 Людмила Фирмаль
2) определить количество кислорода, необходимое для сжигания окиси углерода (II) объемом 168 м3. 2ПК +() 2 2ПК * 2•22.4 22.4 м3 м3 м3 168 Х2 44.8: 168 = 22.4: x2; x2 = 168c J2’4 = 84; x2 = 84 м3 1. если масса газообразного вещества Дана в килограммах, то объем выражается следующим образом: Кубический метр. 3.Найдите количество воздуха, необходимое для реакции. 100 м3 воздуха содержит 91 м3 кислорода* 3 «> 84 м3» 100:* 3 = 21:84; * 3 −10°2 | 84 ^ 400; * 3 = 4(Yu m3 Ответ. 84 м3 требует воздуха 02 или 400 м3.
Смотрите также:
| Расчеты по уравнениям химических реакций | Расчеты, связанные с определением массовых долей растворенных веществ |
| Расчеты с использованием понятия «моль» | Расчеты по термохимическим уравнениям |
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
