Оглавление:


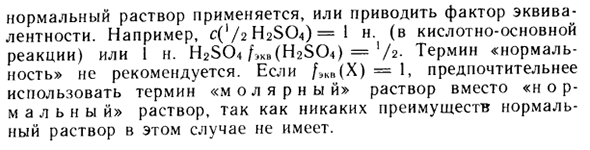

Расчеты в титриметрическом анализе
- Расчет в количественном анализе Расчет результатов анализа титрования основан на принципе эквивалентности, и, соответственно, вещества реагируют друг с другом в равных количествах. Обнаруженное вещество A реагирует с титрантом B согласно формуле. vAA -f vBB- *.
- Продукт реакции. (9.1) Эквивалентная масса этих веществ равна vAM (l) и vB / Vf (£). Где M (A) и M (B) — молярные массы веществ A и B, а vA и vB — стехиометрические коэффициенты или стехиометрические числа. Уравнение (9.1) дается в следующем виде: L-f (vB / vA) B — «- продукт реакции, Здесь vA> vB, то есть одна частица вещества A соответствует vB / vA частицы вещества B. Отношение vA / vB представлено / экв (B) и называется эквивалентным коэффициентом вещества B. />,.(B) = vB / vA.
Реакционная составляющая. Людмила Фирмаль
Коэффициент эквивалентности представляет собой безразмерную величину, меньшую или равную 1. Значение vB / vA B или равное (B) B называется эквивалентной или эквивалентной формой вещества B. Чтобы избежать несоответствий, рекомендуется, чтобы все реакции кислотно-основных взаимодействий приводили к единому общему основанию, которое может быть ионами водорода.
В окислительно-восстановительной реакции количество реагента удобно связано с количеством электронов, которые материал получает или дает в данной полуреакции. Это дает следующее определение: Эквивалентом является конкретная реальная частица или условная частица, которая может: Эквивалент одного иона водорода в кислотно-щелочной реакции Один электрон в окислительно-восстановительной реакции.
Когда используется термин «эквивалент», он всегда должен указывать, к какой конкретной реакции он относится. Под условными частицами понимаются как реальные частицы (молекулы, ионы, электроны и т. Д.), Так и части таких частиц (например, ионы) или их группы. Вместо термина «условные частицы» используются также термины «структурные элементы», «основные фрагменты», «структурные единицы».
- Единицей эквивалента вещества является мол. Например, реакция NaOH + 72H2SO4 = 72Na2SO + + HvO / «« (NaOII) ~ I; U (H2SCM = 1/2 Эквивалентом серной кислоты в этой реакции является U (H2SO “) H2S04 = ‘/ 2H2S04 Для реакции H3PO4 + KOH = KH2PO4 + H20 / bid. А (НзР04) НзР04 = Н3РО4 И для реакции Н3РО4 + 2КОН = К2НРО4 + 2Н20 / „ЛН3РО4) = 7” и /> *, (НзР04) НзР04 = 7 * НзРО «
В половине реакции MnOG + 8H + + L- = Mn2 + + 5H20 /> l. (KMn04) = 7 с и /> ((KMn04) KMn04 = 7 сKMnO Но с половиной реакции MPO4- + 4Н + + 3 <Г = Mn02 -f2Н20 / и (КМп04) = 7з и / или в собственности. (КМПО4ЖМПО4 = 7зКМпО « Эквивалентность и эквивалентность некоторых веществ не являются постоянными значениями, а зависят от стехиометрии реакций, в которых они участвуют.
Вот так Эквивалентный коэффициент f представляет собой число, которое указывает, что фактическая доля частиц вещества X равна одному иону водорода в конкретной кислотно-щелочной реакции или одному электрону в конкретной окислительно-восстановительной реакции. Людмила Фирмаль
Эквивалентом является действительная или условная частица вещества X, которая соответствует одному иону водорода в этой кислотно-основной реакции или одному электрону в этой окислительно-восстановительной реакции. Большое значение при анализе титрования имеет понятие эквивалентной * молярной массы.
Молярная масса эквивалента вещества X представляет собой массу 1 молярного эквивалента этого вещества и равна произведению эквивалентного коэффициента на молярную массу вещества X. Отношение количества эквивалента вещества в растворе к объему раствора называется молярной концентрацией эквивалента с (U (X) X) =.
Например, cC / 2H2SO4) = 0,1 моль / л f Раствор, содержащий 1 моль вещества X на литр, называется «стандартным раствором этого вещества». Вместо указания единицы измерения моль / л может использоваться сокращение «n». Например, 1 н. H2SO4, т.е. 1 моль / 2 молекулы H2SO4. Конкретная реакция, в которой это происходит при использовании эквивалентных молярных концентраций.
Молярная масса эквивалента численно равна граммовому эквиваленту вещества X, согласно более старым терминам. Обычные решения применяются или являются эквивалентными факторами. Например, (‘/ 2 H2SO4) = 1 н. (В кислотно-щелочной реакции) или 1 н. H2SO4 / ^ (bhSCM = ‘/ 2- Термин «нормальность» не рекомендуется. / Если KB (X) = 1, используйте «молярный» раствор вместо «нормального» раствора) У меня нету.
Смотрите также:
Решение задач по аналитической химии
| Стандартизация растворов титрантов | Расчет результата прямого титрования при разном способе выражения концентрации раствора |
| Основные приемы титрования | Расчет результата в методах обратного титрования |
