Оглавление:
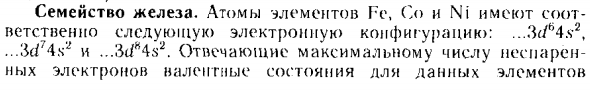







Семейство железа
- Железная семья. Атомы элемента Г-е (‘о и Ni соответствуют Де-факто .3d4 : Я слежу за первым электроном, ну,> kosh}) play: … 3í / ‘’4.s • ^, .4 ^ и … 31 / ^ 4 «^. Максимальное количество не сопряжено Валентные состояния этих элементов Атипичная. Наиболее характерной из них является степень Окисление +2 и +3.
- Кроме того, серия Fe-Co-Ni, стабильность Увеличение количества соединений с низким элементным окислением. В лучшем случае — падает. Железо — самый распространенный металл после алюминия В Земле Ниапе его масса составляет 4% от общей массы Земли Кора. -Массовое содержание коры кобальта и никеля Равно примерно 4-10 » ^ и каждый. И все; <Металл, используемый человечеством, железо.
Наиболее распространенным в природе является алюмосиликат Leza. Людмила Фирмаль
Максимальное значение Все новейшие технологии Изменения в железе и его сплавах . Годовое мировое потребление Железо составляет более 500 миллионов тонн, а потребление никеля низкое (Около 300 000 тонн), еще меньше потребление кобальта (около 20 ООО т). Железо, кобальт и никель великолепны. Сероватый (Fe, Co) или серебристый (Ni) белый металл Тень. Железо и никель легко поддаются ковке и прокату. к Балты тяжелее и ломче.
В отличие от других черных металлов, Co и Ni притягиваются к магниту. Есть несколько Константы, характеризующие физико-химические свойства эле Железный семейный полицейский: Í4 ‘(d) NÍ Плотность, г / с м ‘………………………. 7,9 8,9 8, 9 TiiMiiepaTypa плавления, ° С 1495 1455 Температура кипения, ° С ………….. 2770 2255 2140 Относительный провод Вылет (H g = 1) ………………………………. I) 10,8 14 Относительная теплопроводность (H g = 1) ……………………………………. …….. 10 8 7 Атомный радиус, нм … .. 0,125 0,124
Радиусы ионов E ^^ и m ………………………….. 0,080 0,080 0,079 Энергия ионизации Е. Е. ‘, В 7,87 7,86 7,64 Стандартный электродный потенциал E-7 E, B ………………………………… …………………- «, 44 -0,27-0,25 Стандартное значение потенциала электрода железа Балтика и никель позволяют классифицировать их как промежуточные металлы Химическая активность. В этом случае железо более активно, чем кобальт И никель.
Сухостойкий утюг (компактный) Воздух становится корродированным и покрытым, как только он намокнет Коричневый гидроксид EgOz’nNgO, сыпучий и не консервированный Металл от дальнейшего окисления. Реакция ржавчины Ранг многоступенчатый. Подводя итог, это можно представить следующим уравнением: 4Fe- | -30’¿ — | —2 L H 2O = 2 ( При высоких температурах железо горит, «Оксид железа» Res0 4. При нагревании железо взаимодействует * ■
В технологии железные сплавы обычно называют черными металлами, Металлургическое производство Со многими неметаллами, реакция Реакция особенно интенсивная, Когда железо тонко разделено. В пользу По неметаллической деятельности 11 Условия изображения процесса Твердый раствор (C, 81, S, Р. I), металлоподобные соединения (RszS, Rsz51, Rszr, F’e4N, Re 2Y) или Соль (G’eCl3, Fe5).
Железные гонки легко Создано с помощью кислоты и перенесено из}} 1 Водород: .’e «+ 21 [‘= 1ч’ ^ ‘4— И’ ^ Концентрированная азотная кислота Пассивировать железо. Повторное соотношение Концентрация серной кислоты зависит от концентрации H2504 (рис. X II.1). Три стабильных оксида, соответствующих железу: ReO, ReZO ^ * и Регистрация Все они в основном носят базовый характер.
Руководство Оксиды G»e (0H) 2 и Fe (OH), сокотрофеновые соединения; Re (0 H) 2 выражается как бас, а Re (OP1) s выражается как слабый Бисексуальная черта, которая позволяет вам получить! «Из соли YaG’e () 2- Соль железа Н2Г’о04, железо Существует степень окисления-) -b. Соль железа (II) раствор бамия Светло-зеленый Шина и безводные соли (например, RES) бесцветный.
Это связано с образованием в растворе Состав комплексной соли железа [P, содержащий (H 2 0) b]. Когда цианид калия действует на раствор соли железа (II) Получен белый осадок цианида железа. 1-0- ‘+ 2CN = fch ■ ((: N),. Когда цианид калия является избыточным, осадок растворяется Комплексное солеобразование [Pe (CU) (;], называемое гекса- Цианоферрат калия (P): l-e (<-N), + 4K (: N == K4 (Fe ((: N) „] Гексацианоферрат калия кристаллизуется при 3 (11).
Молекула воды K -1 [Fe (C s) b] -ZNgO, также называемая желтой Соль крови, ири желтая кровь, растворимая в воде Диссоциирует на ионы: К. ([Hh (: N) „1- * 4K ‘llhHG.N) И’ Анион [1-й (ые) й Re ‘*’ * ионы; 4Ne’ch = ^ ■ V., | L ■ e ((: N). |, L Полученный осадок имеет характерный синий цвет. (Прусский синий).
Гексациано под воздействием окислителей Феррат (I) проходит н-гексацианоферрат (I1): , Б | Ге (СК) ор = (1-й ((: Ы) «) ‘ 1h ‘:) 01 часто рассматривается как 01 co; 1b железа железа 1h’ (Not () ;; Гексацианоирон (P1) калия Kz [Re (CU) b 1 также называется Соль красной крови. Ec anion | Fo (CN) r,] ‘■ Телец [рШ реагент для ионов Полученный осадок имеет характерный сильный синий Цвет (цвет быка синий) *.
- Способ получения железа из руды Железооксидный уголь. Расплавленное железо Дает способность растворять углерод во время плавки Сплав с углеродом (до 4%), не чистое железо Это называется чугун. Чугун перерабатывается в сталь (до 2% угля Углерод) и мягкое железо (ковкое) железо (менее 0,3% углерода). Последний кровельный железо, гвозди, Провода и т. Д. II. В настоящее время это время нельзя назвать ни одной индустрией людей Где используется железо и его сплавы 1> 1.
Все железные сплавы делятся на чугун и сталь. Чугун из углерода Существуют различные формы испытаний. Или в форме Fenium Fe;) C (ce \ {e! {Tig) или графит (ламелла, Хлопок или сферический). Из формы графита Свойства чугуна зависят в большой степени. В чугуне, Белый, серый, высокая прочность, технологичность.
Белый чугун содержит весь углерод в форме цементита. Людмила Фирмаль
Поскольку он хрупок, его использование ограничено. главным образом Он идет на обработку стали. Серый чугун (включая только (Слоистый графит) Особенности высокого литейного производства Широко используется в картировании свойств и рефлюкса Ки станки и механизмы. Для многих сортов серого чугуна, 2,4-3,8% -углерода, 1-4% кремния, до 1,4% марганца.
Ковкий чугун получают путем введения специальных добавок (Пример: M ^) В расплавленном железе. Влияние графитовых добавок Кристаллизуется в сферическую форму. Сфероидальный графит Улучшает механические свойства чугуна. Из высокой прочности Чугун изготавливается с помощью коленвалов, насосов, клапанов и т. Д. Путем нагрева чугунно-графитового литья в течение длительного времени Слабая форма предполагается.
Чугун податлив. бухта Кий чугун характеризуется высокими механическими свойствами. Детали сделаны из него, материал должен быть пластиковым Прочный и долговечный (например, задний мост автомобиля). Сталь сначала делится на различные группы. Химический состав и второй 1> 1х, но по назначению. химикат Состав делится на углерод и сплавы [1Ные. *
Качество, которое реагирует на Ян и {t ‘* — это l, lr (.’Dpaa.’l’) 1y Уравнение; K ‘+) He (C s) „) ^ = KI • e (lhCHC N) e | + [Re (SM) «] ‘-KI •’ e [l • o ^ (: N), il Берлин синий и синий синий <> 6 ioitichiosgi sosgaia. Углерод мал в дополнение к углероду (до 2%) Марга [1А и количество кремния (100 вводится при дезоксигенации) Li) и фосфор, и сера. Производство легированной стали Допинг Виадия и его элементы (Cr, N1, Mo И т. Д.) Придаем специфические свойства сплаву: высокий } | ау, пластичность и т. д.)
Сталь начала делиться Специальная структура, инструменты, сталь SSTV. Конструкция 1n ^ 1e стали «1» углерода и 111 Питание. Основные легирующие элементы структуры Сталь (‘r, N1, Mp. Вставка подходит для обработки давлением, Резка хорошо сваривается. Конструкционная сталь Они используются при изготовлении деталей машин, конструкций и Genius. Инструментальная сталь также может быть углеродистой Далеко, legioyantlmi.
Основные легирующие элементы … Характеристики этих сталей следующие: 1 Высокая твердость и долговечность Долговечность и износостойкость. Они используются в производстве резки Измерительные и измерительные инструменты, пресс-формы и др. К стали Специальные свойства включают нержавеющую сталь, термостойкость, Термостойкость, магнетизм, некоторые другие.
Нержавеющая сталь a1 ‘пресс-среда, жаропрочная сталь Устойчивость к коррозии при высоких температурах. С энергией Жаростойкая сталь с высокой механикой важна Характеристики при нагревании до значительной температуры, Важное значение при изготовлении лопаток газовых турбин. По электропорации Технология важна для магнитной стали, используемой для Постоянный магнит и магнитное устройство сердечника, я работаю Переменное поле.
Постоянный магнит сделан из высокого Углеродистая сталь, легированная хромом и вольфрамом. Они полностью намагничены и сохраняют свои остаточные свойства в течение длительного времени. Индукционная. Напротив, ядро сделано из низкоуглеродистой Силиконовая легированная сталь. Они легко перемагничиваются И у этого есть особенность, что электрические потери низки. Чугун дешевле, чем сталь.
Он вряд ли может пластик Деформация, но благодаря своим отличным литейным свойствам Незаменимый материал в нескольких областях техники. С очень устойчив к воде и воздуху. Разбавленная кислота менее растворима, чем железо. Кислород окисляет кобальт только при температуре выше 300 ° С. Взаимодействие кобальта (особенно в виде порошка) при нагревании Есть много неметаллов, таких как железо.
Соединение с ним Содержит галогены (такие как CoCb) — содержит соли, водород и бор Водный раствор. Кобальт также образует соединения, такие как металлы. Тип Co.) C, Co2N и т. Д. Два оксида СоО соответствуют кобальту. И Co ^ C): , Оксиды и их соответствующие гидроксиды имеют преимущества В основном базовый характер. SoaOz ‘- самый мощный окислитель: Со ^ ‘*’ (/ Т * ‘= 1,84 В) *.
Относительно стабильный * сцисия пкислея + 3 кобальта является более сильным окислителем, чем железо , Ге ‘ЧЯ «-0,77В). Смешанный оксид CoO-CogO3, но также оксид энергии Littelfuse. У кобальта способность к соединению Образование. Кроме того, акцепторные свойства более характерны В случае Co * ‘*’, чем в Co * , ионы Co ‘ «^ являются катионами Анионные комплексы (координационное число Co ^ ”*” — это ty), наномер [Co (NH; i) r, | S! S и K 🙂 [S o (S 02) c].
Заявление Прибалтика в основном связана с производством сплавов. Введен в некоторые сплавы для упрочнения сплава. Среди таких сплавов стеллит (сплав кобальта С хромом и вольфрамом, используемым в качестве структуры) Материал турбинной футеровки и выигрыша (жесткий металл), Содержание 10% Со. Изотоп «» «Со широко используется в меди Киёси в борьбе с раком («Кобальтовая пушка»). N и Kel не окисляются на воздухе и легко растворяются.
Только с разбавленной азотной кислотой. Химическая стойкость Никель, связанный из-за тенденции пассивации На поверхности металла образуется защитный оксид Movie. Начинает взаимодействовать только с кислородом При 500 ° C и только в основном состоянии при нагревании Ni реагирует с галогенами, серой и другими неметаллами. мучительный С ними он образует соединения, как и многие элементы II Переменный состав (включая такие вещи, как металлы).
Наиболее важные из соединений никеля В то же время степень окисления никеля составляет +2. Оксид NiO Гидроксид Ni (0H) 2 не растворяется в воде, но легко растворяется Они содержатся в кислоте и аммиаке. Для взаимодействия Комплексное образование ионов: Координационные числа 4 и 6 характерны для ионов. Соединения никеля (II I), важные для практики Оксид Ni ^ O.j, используемый в производстве щелочи Аккумулятор.
Большая часть металлического никеля Различные сплавы. Никелевый базовый сплав Делится на особую термостойкость, магнетизм и сплав Наиболее важные жаропрочные никелевые сплавы включают нимоник (59% Ni, 20% Cr, 16% Co, остальные — T1, A1, Fe, Mn, S i)) и инконель (73% Ni, 15% Cr, 7% Fe, остальное Ti, A1, Nb, Mn, Si). Эти сплавы используются в современных турбинах Реактивный двигатель, который достигает 800-900 ° C Никель используется в качестве металлического связующего.
Местный керамический жаропрочный сплав, удерживающий мех Характеристика ИРИ составляет 1000— 1100 ° С. Для термостойкости Сплав содержит нихром, используемый в производстве Ленивый элемент электронагревателя. И с магнетизмом Сплав никеля пермаллой (78,5% N1, остальное Re), он может быть намагничен интенсивно, даже если слабый Магнитное поле с очень высокой начальной проницаемостью Мост.
Специальные сплавы включают никелевые сплавы Монель-металл (30% Cu, оставшийся N1), инвар (36% N1, 0,5% Mn, 0,5% С, остальное Re), платина (4 5% N 1, 0, 1 5% С, остальное Новый Ре). Все эти сплавы уникальны (для каждого типа). так Например, инвар фактически не расширяется при нагревании До 100 ° C, а платина имеет коэффициент теплового расширения Рений такой же как стекло и используется для пайки Втулка металлических контактов в стекле. Чистый никель используется Никелирование не требуется. Наносится мелко рубленый никель В качестве катализатора.
Смотрите также:
| Элементы подгруппы хрома | Платиновые металлы |
| Элементы подгруппы марганца | Элементы подгруппы меди |
