Оглавление:






























Сера
- Серный. Этот элемент был известен еще древним Egyptians. In в теоретической концепции алхимика сера играла большую роль. Потому что сера считалась наиболее полным показателем воспламеняемости, 1 из «основных принципов» природы. По содержанию в земной коре (0,03%) он относится к очень распространенному элементу.
- Формы серы в природе разнообразны. Природные месторождения сравнительно редки, большая часть серы связана с металлами различных минералов, и их можно разделить на 2 большие группы серы и сульфатов. Особое значение в технологии производства серы имеет пирит (FeS2). 2-й тип минерала включает, например, гипс (CaS (>4-2H20).
Из минералов первого типа. Людмила Фирмаль
Кроме того, соединения серы обычно присутствуют в вулканических газах и воде некоторых минеральных источников. Свободная сера доступна из природных месторождений или соединений. Практически все производство в мире осуществляется по первому варианту, а технологический процесс ограничивается выделением серы из смешанных пород (песка, глины и др.), что легче всего достигается выплавкой серы.
Обычно сера, полученная из природных месторождений, содержит impurities. To очищают его, перегоняют в специальной печи (Рис. VIII-1).Пар серы, нагретый в чаше А и сброшенный в камеру, быстро остывает и оседает на стенках в виде мелких частиц пыли («серного цвета»).Когда камера B нагревается выше 120°C, жидкая сера получается и затвердевает.
Такая выплавленная сера обычно продается 7 Ежегодное потребление серы в мире составляет около 2000 тысяч тонн. Его промышленными потребителями являются различные отрасли промышленности, такие как серная кислота, бумага, резина и спички. Сера также широко используется в сельскохозяйственных вредителях, фейерверках и медицинских деталях.
Чистая сера представляет собой желтое кристаллическое вещество с плотностью 2,1 г / см3, плавящееся при 119°С и кипящее при 445 ° С. Она обладает очень плохой проводимостью тепла и электричества. Сера нерастворима в воде. Его лучшим растворителем является дисульфид углерода (CS2).
В холоде сера относительно инертна (энергетически она соединяется только с фтором), но при нагревании становится очень химически активной, реагируя с хлором и бромом (не реагирует с йодом), кислородом, водородом и другими веществами. metals. As в результате реакции последнего типа образуются соответствующие соединения серы, например: Fe + S = FeS-f 23 ккал В нормальных условиях сера не соединяется с водородом.
Обратимая реакция происходит только при нагревании H2-H2S-f 5 ккал Равновесие, где около 350°C сдвигается вправо и влево, как температура rises. In дело в том, что сероводород обычно получают путем воздействия разбавленной кислоты на сульфид железа. FeS + 2CH1 = FeCl2 + H2S | Молекулы H2S имеют структуру равнобедренного треугольника с атомом серы в центре[d(H S)= 1.33 A, a = 92 e].
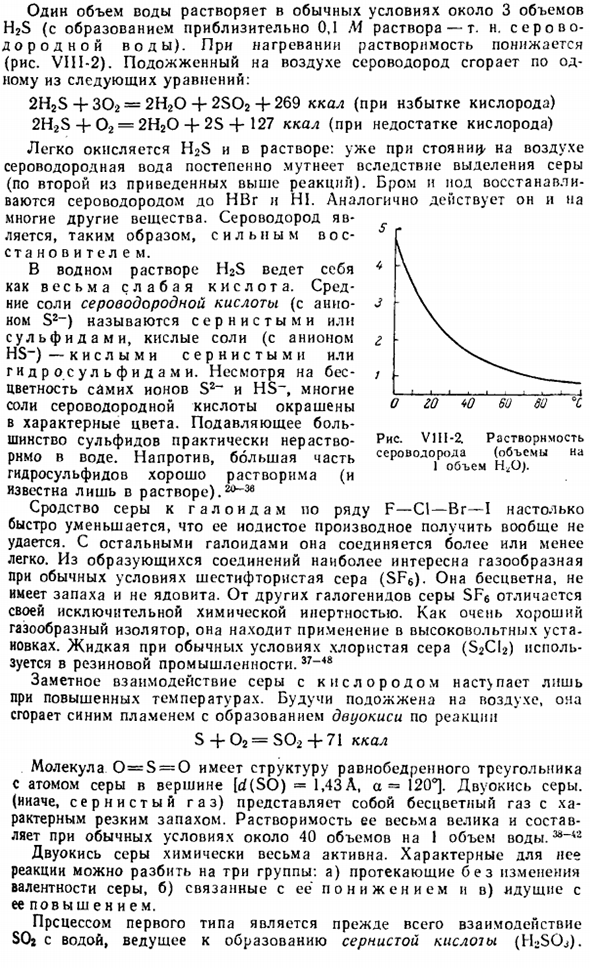
Сероводород является бесцветным, высокотоксичным газом, и его характерный запах (тухлое яйцо) уже обнаружен около 100 000 частей на 1 часть воздуха. Диаграмма VIII-1.Печь для извлечения серы. 1 объем воды растворяется примерно в 3 объемах H2S при нормальных условиях (образование раствора около 0,1 м-так называемой сероводородной воды).При нагревании растворимость уменьшается(рис. VIII-2).
Сероводород, воспламененный в воздухе, выгорает по одной из следующих формул: 2H2S + 302 = 2H20 + 2S02 + 269 ккал (избыток кислорода) 2H2S + 02 = 2H20 + 2S 4-127 ккал(недостаток кислорода) Также H2S легко окисляется в растворе. Даже если оставить сероводород в воздухе, вода постепенно станет мутной из-за выделения серы(согласно 2-й реакции, описанной выше).
Бром и йод восстанавливаются до HBr и HI водородом sulfide. It действует и на многие другие вещества. Поэтому сероводород является мощным восстановителем. В водных растворах H2S ведет себя как очень слабая кислота. Соли нейтрального сероводорода (включая анион S2 -) называются сернистыми или сульфидными, в то время как кислотные соли (включая анион HS〜) называются кислотной серой или гидросульфидом. S2-и HS-ионы сами по себе бесцветны, но многие соли сероводорода окрашены в характерный цвет.
Большинство сульфидов на самом деле нерастворимы в воде. water. In напротив, большинство гидросульфидов очень растворимы (и известны только в растворе). Сродство серы к галогенам в ряду F_Cl_Br_I очень быстро снижается, поэтому ее иодидные производные не получают вообще. С другими галогенами его несколько легче соединить. Среди образующихся соединений наибольший интерес представляет газообразная фтористая сера (SF6) при нормальных условиях conditions.
It бесцветен, непахуч и нетоксичен. SF6 отличается от других галогенированных сер в своей исключительной химической инертности. Очень хороший газовый изолятор используется в системах высокого напряжения. В нормальных условиях хлорид серы (S2CI2) используется в резиновой промышленности. Замечательное взаимодействие серы и кислорода происходит только при высоких температурах.
Если вы запустите его в воздухе, он будет гореть синим пламенем и производить диоксиды по реакции S + 02 = S02 + 71 ккал Молекула 0 = S = 0 имеет структуру равнобедренного треугольника с атомом серы в вершине Irf (SO) −1.43 A, a = 120°.Диоксид серы (iache, сернистый газ) — бесцветный газ с характерным резким запахом. Его растворимость очень высока, и в нормальных условиях она составляет около 1 объема на 40 объемов воды. 3 * — v-диоксид серы химически очень активен.
Характерные реакции на него можно разделить на 3 группы: А) протекает без изменения валентности серы, б)связано с ее восстановлением, в)протекает с ее увеличением. Первый тип процесса-это прежде всего взаимодействие SOi с водой и серной кислотой(HjSOJ. Рисунок v1i1-2L растворимость сероводорода (Объем 1 h <Oj на объем. Последняя, представляющая собой кислоту средней прочности, при этом нестабильна. time.
So, в водном растворе диоксида серы одновременно происходит следующее равновесие: Н20 + С02 H2S03H4-HS05 2Н ’+ С03′ Из-за постоянного присутствия очень большого процента диоксида серы, который химически не связан с водой, возникает резкий запах сернистого кислотного раствора occurs. In Свободное государство, оно не выделяется.
При нагревании раствор сернистого диоксида серы испаряется, в результате чего вышеупомянутое равновесие смещается влево. Если же, наоборот, добавить щелочь, то равновесие сдвигается вправо(за счет связывания ионов Н), и жидкость, содержащая соответствующие сульфаты (называемые С и Р и др.) перестает пахнуть сернистым газом.
Будучи двухосновной, сернистая кислота образует ряд из 2 солей: средней (сульфит) и кислой (бисульфит). Как найти с-н Hsuj ионы сами по себе, как правило, бесцветный. Почти все соли сернистой кислоты стабильны только в растворе, а для сульфитов она очень легко растворяется, главным образом в натриевых и калиевых солях.
Химические процессы с уменьшением валентности серы не характерны для диоксида серы. Восстановление S02 монооксидом углерода, которое быстро прогрессирует в присутствии катализатора 500°С (боксита), действительно важно. Вот именно. + 2CO 2C02 + S + 64 ккал Иногда его используют для извлечения серы из отходящих газов металлургических заводов.
Другим интересным примером является взаимодействие S02 с сероводородом по следующему уравнению: S02 + 2H2S = 2NoO + 3S + 56 ккал Эта реакция протекает спонтанно уже при нормальных условиях, но только с заметной скоростью в присутствии следовых количеств (то есть очень малых количеств) воды.
Наиболее характерна реакция на производное четвертичной серы (связанная с увеличением валентности: серная кислота и ее соли являются одновременно мощными восстановителями. Оставленный на воздухе раствор постепенно (очень медленно) добавляет кислород. 2na2so J 4-02 = 2 \ Ta2S04 Окисление серной кислоты и сульфита протекает так быстро (почти мгновенно), как не сравнить, под действием таких окислителей, как KMnO, Br2, 12.
As в результате окисления образуются серная кислота или ее соли. Сульфиты также могут связывать серу вместе с кислородом, например, по следующей реакции она становится солью сернистой кислоты (иначе-т и серная кислота: Na2S03-f S = Na2S203 Как и в случае с кислородом, добавление серы происходит медленно, и для того, чтобы получить сульфаты (иначе тиосульфон С), необходимо прокипятить реакционную смесь.
Сернистая кислота соответствует структурной формуле Или ч — °з° Ч-о / ^ ч-з / ^ о Пока не ясно, что это такое right. In в обеих формулах значение атома серы различно(4-6 и −2).Это следует учитывать при создании уравнений реакций с участием H2S203 или его солей. Сернистая кислота близка по прочности к серной кислоте, но в свободном состоянии она неустойчива, а при выделении(путем подкисления физиологическим раствором) разлагается на серную кислоту и серу.
Напротив, многие из его солей(известны только те, что в нем содержатся) являются stable. As как правило, они бесцветны и очень хорошо растворяются в воде. Наиболее важным является Na2S203•5H20 (так называемый гипосульфит).Эта соль в основном используется в фотографии и в качестве сильного восстановителя. Например, его легко окислить, но реакция идет: Na> S203-f 4C12 + 5H20 = 2H2S04-f 2NaCl-f6HC1 Гипосульфит также используется в медицине.
Что касается самого диоксида серы, то процесс, приводящий к увеличению валентности серы, гораздо сложнее, чем диоксид серы и его соли. Наиболее важной из этих реакций является взаимодействие SO2 с хлором и кислородом.
Диоксид серы связывается непосредственно с хлором (под прямыми солнечными лучами) по реакции S02 + C12 = S02C12-b 22 ккал Полученный сульфурилхлорид представляет собой бесцветную жидкость с резким запахом. Холодная вода действует только медленно, но горячая вода быстро разрушается из-за образования серной и соляной кислот: S02C12 + 2H20 = H2S04 + 2CH1
При взаимодействии с водой вещества, образующие смесь Галогенида водорода и других кислот, называются последними. Поэтому сульфурилхлорид является сульфатным продуктом. Если оба гидроксильсульфурилхлорида, которые заменяются хлором, можно считать серной кислотой, то продуктом аналогичного замещения только одного из них является хлорсульфоновая кислота.: о ^ н о ^ ИЦ ^ К хлорозе серной кислоты…
Хлористый феррил Кислота SO3 и HCl могут быть получены в прямой комбинации, и это бесцветная жидкость с резким запахом, как сульфурилхлорид. Хлорсульфоновая кислота [HSOjCl или S02 (0H) C1) быстро разлагается на HCl и H2SO4.Как и сульфурилхлорид, он используется в органическом синтезе.
Сама реакция очень экзотермична, но кислородсодержащее соединение S02 является более сложным, чем использование хлора. 2S02 + 02 = 2S03-f-47 ккал Этот процесс протекает при достаточно высокой температуре и заметной скорости только в присутствии катализатора. Когда пары триоксида серы быстро конденсируются, образуется бесцветная, ледяная масса, которая медленно (быстрее-под действием следовых количеств воды) превращается в белые, шелковистые кристаллы.
Обе модификации очень гигроскопичны и являются дымом в воздухе. air. As как видно из рисунка VII1-3, выраженное разложение S03 при нагревании (за счет реакции, противоположной его образованию) происходит только при 400°С и выше.7_ * 9 Триоксид серы характеризуется сильными окислительными свойствами (обычно снижается до S02).
С другой стороны, это кислый ангидрид, и образование H2S04 из серного ангидрида (S03) и воды сопровождается большим выделением тепла. Н20+ S03 = H2S04 + 15 ккал Чистая 100%серная кислота (то есть моногидрат) представляет собой бесцветную маслянистую жидкость, затвердевающую при+ 10°С в кристаллическую массу.
Плотность реактивной концентрированной кислоты обычно составляет 1,84 г / см3 и содержит около 95% H2SO4. −20 ° C. It твердеет только в 90-92 и ниже. Концентрированный H2S04 является довольно сильным окислителем, особенно при нагревании (обычно снижается до S02).Например, он окисляет HI и некоторое HBr (не HCl) для того чтобы освободить gallons.
It окисляет многие металлы, такие как медь, ртуть (золото и платина устойчивы к H2S04).Таким образом, взаимодействие меди с формулой Cu-f 2H2S04 = CuS04 + S02-f 2нао На самом деле, тот факт, что очень сильная (более 75%) серная кислота не действует на железо, действительно важен. Это позволяет хранить и транспортировать в стальных резервуарах. Напротив, разбавленный H2S04 легко растворяет железо с образованием водорода. Окислительные свойства ему не свойственны.
Сильная серная кислота интенсивно впитывает влагу, поэтому ее часто используют для осушки газов. Из многих органических веществ, в том числе водорода и кислорода, он берет воду. И это часто используется в технике. Это(и окислительные свойства мощного H2S04) оказывают связанное разрушительное воздействие на растительные и животные ткани.
Серную кислоту, случайно попавшую на кожу или одежду, следует немедленно смыть большим количеством воды, смочить пораженный участок разбавленным раствором аммиака и снова промыть водой. Растворение концентрированной серной кислоты в воде сопровождается (и несколько снижается) значительным нагревом* Рисунок VHI-равновесие термической диссоциации SOj. Общий объем системы).
Моногидрат почти не переносит электрический ток current. In напротив, водный раствор серной кислоты является хорошим проводником. VII1-4, Как видно из рисунка. Приблизительно 30%кислоты указывает на максимальную проводимость. Минимальное значение на кривой соответствует гидрату состава H2SO4•NgO. 94-98
Как сильно-двухосновная кислота, H2SO обеспечивает 2 серии солей: среднюю (сульфат) и кислую(тяжелый сульфат), последняя отделяет только некоторые из наиболее активных металлов твердых тел (Na, K и др.).Большинство сульфатов бесцветны, хорошо кристаллизуются и легко растворимы в воде.
Среди наиболее распространенных производных металлов, слабо растворимых CaSOt, еще меньше PbSOi и практически нерастворимых BaSO4. Что касается нагрева, сульфаты можно условно разделить на 2 группы. Некоторые из них (например, соли Na, K, BA) не разлагаются даже при 1000°С, в то время как другие (например, соли CU, AI, Fe) разлагаются на S03 с оксидами металлов при гораздо более низких температурах.
Некоторые сульфаты, которые содержат кристаллическую воду, также можно назвать полосами. Например, из CuSO5-5H20-сульфат меди, из FeSO1•7H20-сульфат железа. Многие соли H2SOi имеют широкий спектр технических свойств. uses. It особенно велика она для самой серной кислоты, которая потребляется в больших количествах в таких отраслях промышленности, как химическая, нефтяная и металлургическая.
Производство серной кислоты в СССР в 1972 году составляло 1370 млн тонн (в 1940 году 150 млн тонн). 。А в 1913 году 12 млн г). Для промышленного производства серной кислоты применяют 2 способа контакта с азотистой кислотой. Основным исходным продуктом в обоих случаях является диоксид серы, который получают путем сжигания в воздухе серы (США) или пирита-FeS2(большинство европейских стран, в том числе СССР).
S02 отработавших газов, образующихся при выплавке металлов (Cu, Zn, Pb 11 и др.) Из сернистых руд, также частично используется.02 — ’ 06 Нитритный метод получения H2SO2 был впервые применен в Серине в 18 веке. Его химическая сущность может быть выражена следующими реакциями: I. S02 + H20 + N02 = H2S04 + NO II. 2N0 + 02 = 2N02 Из первой формулы видно, что окислитель диоксид азота (N02) восстанавливается до оксида азота (N0), а последний, при взаимодействии с кислородом в атмосфере, снова превращается в диоксид по 2-й формуле.
Поэтому, N0.It действует как кислород carrier. In другими словами, это по существу катализатор для окисления S02 кислородом воздуха. До 20-х годов этого столетия процесс получения серной кислоты нитросимовым методом осуществлялся в большой свинцовой камере(камерный метод).Сейчас его проводят в специальной башне (башенный метод).Кислота, полученная башенным методом, как правило, содержит 7 г% H2S04 и несколько загрязнена различными примесями.
Основным потребителем этой кислоты является промышленность минеральных удобрений 107 Го о так 00 йоу°:$ Рисунок VH1-4.Проводимость раствора серной кислоты. Контакт, еще один современный способ получения серной кислоты, не был освоен промышленностью до конца прошлого века. Его основой является реакция, описанная выше. 2SOa-f 02 2S03 + 47 ккал В присутствии платинового катализатора он почти полностью течет слева направо при температуре около 400 ° С. полученный S03 задерживается в сильной серной кислоте.
Себестоимость производства контактным способом несколько выше, чем у азотной кислоты, но серная кислота произвольно сильна и очень чиста. Последнее обусловлено тщательной предварительной очисткой газов, образующихся при сжигании пирита, что необходимо для обеспечения нормальной работы катализатора. Основными потребителями контактной серной кислоты являются различные химические и нефтяные отрасли промышленности (для переработки нефтепродуктов).
Доля контактных методов в общем объеме производства серной кислоты увеличивается с каждым годом 108 Раствор S03 в серной кислоте является дымом дыма в воздухе из-за образования паров серного ангидрида. Поэтому серную кислоту с растворенным S03 называют » дымящей «(иначе — «дымящая серная кислота»). H2SSO * растворяет серный ангидрид в произвольной пропорции, поэтому состав олеума, выраженный формулой H2S0i-xS03, может быть различным. при Х = 1 образуются бесцветные кристаллы пирофосфата (H2S2O7).Его структура опущена формулой HO-S02-O-S02-OH.
Его соли (пиросульфат или пиросульфат) могут быть получены реакцией, например нагреванием соответствующего бисульфата 2KHS0 «= H20t + K2S207 Они представляют собой бесцветное кристаллическое вещество под воздействием воды, которое возвращается в тяжелый сульфат., 09-П2 При электролизе насыщенного раствора бисульфата калия в катоде образуется водород, который накапливает Кон, а на аноде образуется серная кислота по схеме 2HSOJ-2е= H2S208.
В результате последующей нейтрализации (сульфат калия или персульфат калия) K2S20 осаждается в виде бесцветных кристаллов из-за их низкого рН. большинство других сульфатов очень растворимы в воде. Все персульфаты являются сильными окислителями. Например, серебро может быть окислено по следующему уравнению (NH ^ SA.+ 2Ag = Ag2S04 +(NH4)2S04 Эта реакция используется на фотографии. Свободная серная кислота представляет собой бесцветный гигроскопический Кристалл.
Структура его молекулы представлена формулой HO-S02-O-O-S02-OH. То есть, он содержит поперечные нити. Пространственная структура соответствующего Иона S20, — показана на рисунке. VII1-5.Каждая половина рисунка индивидуально соответствует структуре сульфат-ионов. ПЗ-119 Рисунки V II1-5.Ионная структура С20 Добавь 1) сера меткаменного происхождения состоит из 4 изотопов: MS (95,0%). WS(0,76%). МС (4,22%) и МС (0,02%).
Изотопный состав серы различных наземных объектов очень близок к данному, но не полностью constant. In в этом отношении сера подобна кислороду, а состав в воздухе (99,76% S; 0,04%; 70; 0,20%•S) и других природных веществ незначителен, но все же показывает заметную разницу.
2)в основном состоянии атом серы имеет структуру внешнего электронного слоя 3Z’3 / m4,и, как кислород, он divalent. To возбуждение Квадрантного состояния (3s * 3ps4$) требует затрат в 150 ккал / г атомов. Это примерно на 6J> ккал / г атомов меньше, чем кислорода (V!§ 3 Добавить.12).Сравните энергию непрерывной ионизации атомов кислорода и серы со следующей (немного): I II III IV V VI О….. 13.61 35.11 64.49 77.39 113.87 133.08 С….. 10.36 23.4 35.0 47.29 72.С 88.03 На высоте около 200 метров ионы O * становятся основной формой свободного кислорода в атмосфере.
3) сродство нейтрального атома серы к 1 электрону положительное(+48 ккал / г атома). 2 электрона-отрицательные (-80 ккал / г атомов).Аналогичные значения атомов кислорода составляют приблизительно+34 и −156 ккал / г атомов. Такое уменьшение явно связано с высокой плотностью отрицательного заряда на поверхности атома кислорода (см. VII§ 4,
14).С точки зрения идеи Косселла, переход 4 4-2e с большим энергопотреблением блокируется энергией взаимодействия 11 «ионов»и соответствующих положительных ионов при образовании compound. In на самом деле, ни сера, ни кислород не образуют чистой ионной связи. (5) растения накапливают серу главным образом в семенах и листьях.
Например, капуста содержит около 0,8%серы (в пересчете на сухое вещество).у животных содержание шерсти особенно высокое (до 5%).Гвозди, рога, копыта. Интересно, что состав пепла на волосах во многом зависит от его цвета. (3) в древности и в середине века серу добывали из всех коренных месторождений ВНА очень примитивным способом (рис. ВУИ-6). в землю закапывали глиняный горшок.
Поместите еще один горшок с отверстием в нижней части. Последний был заполнен серосодержащими породами и нагрет от солнца. outside. At в то же время сера плавилась и сливалась в Нижний котел. В настоящее время выплавку природной серы обычно осуществляют путем нагрева исходной (или предварительно концентрированной) руды до 140-150 ° С и обработки ее паром. Менее распространенным является нагрев руды путем сжигания части серы, содержащейся в руде.
В настоящее время много серы получают из металлургических газов и нефтяного газа, а также при переработке нефти из примесей сернистых соединений. 0 некоторые очень богатые залежи серы долгое время не использовались промышленно из-за особых условий их залегания-под толстым слоем песка, на глубине 200-300 м. m. To их.
Ситуация изменилась только в начале этого столетия, когда был изобретен способ очистки подземной серы и извлечения ее на поверхность в жидком состоянии. Этот метод основан на плавкости и относительно низкой плотности серы. Суть процесса заключается в следующем: в серный слон вводится специальная трубопроводная система. Это графически показано на рисунке 2. VIII-7.By Рисунок Vfff-in.
An массив серы получают путем подземной плавки. Рисунок Вффф-г. Подсмепов плавка Силла схема установки. Джиг джиг чая сбкпочто Наружная труба начинает воду нагретую до 170CC (под давлением).При попадании в руду расплавляется сера, которая собирается в углублении, образованном под трубой. Горячий воздух, поступающий из внутренней трубы, смешивается с жидкой серой Центральная труба выводит его на поверхность и втекает в окруженное досками пространство, постепенно образуя огромный горный массив (рис. VI11-8).
Метод подземной плавки применим только к достаточно мощным и обильным deposits. It требует большого расхода воды и топлива, в то же время, только 50% всей серы в руде можно извлечь, и цвет серы всегда несколько загрязнен с различным impurities. It часто перекристаллизовывается из сероуглерода для очистки серы. Такая сера обычно есть、__ содержит N кристаллов растворителя. Глубокая очистка серы может быть достигнута многократным нагреванием расплава в течение длительного времени в присутствии оксида магния.
Очень чистая сера совершенно не имеет запаха и склонна к переохлаждению. 8) элементарная сера присутствует в виде, показанном на рисунке, при нормальных условиях. 8 VI11-9 молекулы атомного кольца (энергия связи S-S оценивается в 62 ppm моль, а ее силовая постоянная равна k = 2).2 формы типичны для кристаллов серы образованных этими molecules. As как видно из принципиальной схемы VIII-10 диаграммы состояния, нормальная желтая сера (SQ) плотностью 95,4°С, 2,07 г / см3, кристаллизуется в ромбической системе、 Т. болен. П2. 8°С (быстрый нагрев).
Напротив: при температуре более 95,4°с моноклинные бледно-желтые кристаллы с плотностью 1,96 г / см3 и др. стабильны. 119.3 * 0(т. е. СП).Превращение тепла из одной формы в другую составляет всего 0,7 мкал / моль. Внешний вид характерных кристаллов показан на рисунке. VI1I-11.Интересно, что из-за трения сера приобретает сильный отрицательный заряд, а при охлаждении ниже npi она превращается в 50 X. Рисунок VtIJ-9.Структура молекулы равна s$. 7) m расплавленная сера.
Температура Пара Р2, Б * E5L серия \ С с Р9.3 \ ’ы Рисунок VI11-10.Диаграмма состояния сиширы. 9) при особых условиях удалось получить и другие виды неустойчивых сортов серы. Например, когда сильно нагретый пар серы замораживается (с жидким азотом), его фиолетовая модификация стабилизируется только ниже −80°C, по-видимому, образованная молекулами 2$.Форма, извлеченная из раствора Найсджоя, который был подкислен толуолом, была изучена лучше, чем другие.
Желто-оранжевые кристаллы образуются кольцевидными молекулами Se [параметры d (SS) = 2.06 A и SSS * =102®). при тушении насыщенного раствора серы в бензоле может быть получена метастабильная»перламутровая»модификация (SY), состоящая из молекул S*. obtained. In довольно сложным способом была получена форма, состоящая из циклической молекулы Sta 1 V, С. ► ’/АС4-> С2
Поэтому, когда температура повышается, равновесие смещается все больше и больше вправо. Внешним признаком этого является изменение цвета пара вблизи точки II В. В. Некрасов Рисунок VIIIII. Характерная форма кристаллов серы. Рисунок VI11-12.Изменение вязкости серы с температурой. Кипяток оранжево-желтый, при дальнейшем нагревании он сначала краснеет, а затем начинает синеть, а через 650 * 0 приобретает соломенный цвет. Кипение паров серы содержит около 59%S (по объему). 34%с*.
Небольшие примеси 4% S»и 3% S2 нечетных молекул (S3, Ss. С7).Очевидно, что все эти молекулы Sn (кроме S2) имеют циклический характер. structure. At около 900°С, пар серы почти исключительно состоит из молекул Si (расстояние d (SS)= 1.89 A).Энергия диссоциации на атомы составляет 100 ккал / моль, и эта диссоциация заметна примерно с 1500°С. теплота атомизации (25°С) серы составляет 65 ккал / г атомов.
13) согласно электронной структуре, молекула S * подобна молекуле O .Магнитные свойства последнего указывают на наличие в нем 2 замечательных электронов. Если атом кислорода имеет четное число внешних электронов(6), то это возможно только для простых (: 0-6:) или тройных (: OZY:) связей. Длина простой связи O — O составляет около 1,50 л, а в молекуле Og-1,21 л, поэтому связь тройная.
Появление структуры: 0 = 0: непарные электроны связаны с расходом энергии для перехода на более высокий энергетический уровень (3 секунды) и преодоления их взаимного отталкивания (за счет параллелизма спины).Но такие затраты блокируются энергией образования тройки bond.
As как видно из спектральных данных, переход к вышеуказанной электронной структуре 0 = 0, которая обычно принимается в молекулах кислорода, требует затрат 22 ккал / mol. So, эта структура является фундаментальной для молекул кислорода, но она возбуждается (энергия диссоциации 97 ккал / моль). Константа силы связи молекулы составляет 11,4,энергия диссоциации атома-119 ккал’, моль.
Сродство к электронам 12 ккал / моль и потенциал ионизации 12.2 вольт (12.8 < * для молекул Oj * * термическая диссоциация кислорода при нормальном давлении будет заметна примерно с 2000°C. At около 2300°C она достигает 1%, а при 5000°C проходит почти completely. As уже упоминалось (IV§ 1additional 19), атомарный кислород гораздо более активен, чем молекулярный кислород. То же самое относится и к атомной сере.
14) при быстром охлаждении жидкой серы или жидких паров они не успевают перейти в равновесное состояние, существующее в них. Полученная твердая фаза (Мп. Около 110°C) содержит 2 типа серы-растворимые в дисульфиде углерода (т. е. SjJ и нерастворимые (т. е. S^)).Примесь S ^обусловлена неполной растворимостью CS3 в частности многие другие S ^содержат коричневую» пластиковую » серу, подобную по вязкости каучуку, полученную заливкой расплава, нагретого до 300°C или более, в холодную water.
An удлиненная нить пластичной серы показана на рисунке VI11-13.Во время хранения пластиковая сера быстро твердеет, но полностью превращается в S ^ cr медленно. 15) ниже приведены данные по растворимости серы (S0) в сероуглероде и бензоле (100 г серы в насыщенном растворе). Температура, ° С0 20 40СО80 100 Растворимость: в CSJ. •*••18.0 29.5 50.0 66.0 79.0 92.0 В Свнб…. 1.0 1.7 3.2 6.0 10.5 17.5
Сера хорошо растворяется в скипидаре. Ия более или менее растворим во многих других органических жидкостях. Например, 100 г эфира растворяют примерно в 0,2 г серы при нормальных условиях. 16) чистая сера не токсична. Прием внутрь небольших количеств способствует всасыванию абсцессов, особенно полезен при hemo-nuclei.
At в дозе около 1 г его можно назначать в качестве слабительного средства. Человеческое тело не обнаружено HIIC схема S Высокое содержание серы и ее длительное потребление может негативно сказаться на работе печени и кишечника. Очень мелко (осажденная) сера входит в состав многих мазей, направленных на уход за кожей и лечение кожных заболеваний.
17) интересны эксперименты по использованию серы в строительстве. Расплавленная сера смешивается со стеклянными волокнами и cooled. It становится прочным строительным материалом, который передает влагу и холод. 18) сера действует как Вешва, способная к длительному хранению простейших образцов электрета, то есть заряда (включающего различные символы на противоположной поверхности), который может генерировать электрическое поле в окружающем пространстве.
Электретное состояние обычно достигается нагреванием пластины подходящего вещества с достаточно сильным электрическим полем, а затем ее охлаждением. Электрет является электрическим аналогом постоянного магнита, так сказать, и имеет множество практических применений. 19) наиболее характерное валентное состояние серы соответствует значению 2. 0. +4 и+6.Схема окислительно-восстановительного потенциала, соответствующая переходу между ними, показана ниже.
Больной…… −2 0 +4 +0 Кислая среда…. +0.14 Дж +0.45} +0.17 Щелочная среда… Я −0.4 с(-0.61 Джей Джей −0.91 20) удобный способ изготовления HjS заключается в нагревании сплава порошкообразной серы и парафина и измельченного асбеста (примерно 3: 5: 2 по массе) не менее 170°C. Когда он остывает, реакция прекращается, но снова вызывается нагреванием.
Исходный сплав может быть подготовлен для дальнейшего использования и потребляться по мере необходимости(в 1 грамме вы получите около 150 мл HjS). 21) очень чистый сероводород (Мп.- 80.Mp-G0°C) получают путем пропускания смеси H через пемзу, нагретую до 600 см3 парами серы. Критическая температура H2S составляет 89°C при критическом давлении 100 атм. Термическая диссоциация H2S начинается примерно при 400°C, а примерно при 1700 ° C он становится почти полиолом.
22) молекула H2S имеет треугольную структуру\ d (HS)= «1.33 A. Z. HSH 92′) и имеет полярность (q = 0.93).Средняя энергия связи HS составляет 87 ккал / моль(элиминация первого атома водорода составляет от 2 до 91-83 ккал / моль), а константа силы связи K ≈ 4,3. Потенциал ионизации молекул HJS составляет 10,5 вольт. Сродство к электронам оценивается в 26 ккал / моль, а сродство к протонам-в 178 ккал / моль(см. Приложение 5 к V§ 5).
Сульфгидрильная группа (SH) входит в состав биологически важных органических соединений. Электронное сродство SH-радикалов составляет 53 ккал / моль. Также для дипольного момента задано значение= 1,94. 23) в жидком состоянии HjS проводит очень плохой ток по сравнению с водой, так как его собственная электролитическая диссоциация незначительна:| SHJ / [SH»| = 3 * 10″ «33。 0°C) в качестве растворителя он больше похож на органическую жидкость, чем на воду, особенно, на самом деле он плавит лед.
Твердое вещество HjS имеет плотную структуру с 12 ближайшими соседями в каждой молекуле (то есть оно полностью отличается от ЛСД), теплота плавления сероводорода составляет 0,6 ккал / моль%, а теплота испарения-4,5 ккал / моль. 24)в воздухе сероводород воспламеняется при температуре около 300°С. 4-45 об. Взрывчатая смесь с воздухом, содержащим% H2S. токсичность сероводорода часто недооценивается и работает с ним без надлежащих мер предосторожности.
Между тем, уже 0,1% HtS в воздухе сразу вызывает тяжелое отравление. Если вдыхать значительную концентрацию сероводорода, то может произойти Мговейно, обморок или даже смерть от паралича дыхания(Если вы травмированы) Его не сразу удалили из отравленной атмосферы).Первым симптомом острого отравления является исчезновение запаха.
Затем появляются головная боль, головокружение и тошнота. Иногда, через некоторое время, происходит внезапный обморок. Противоядие-это прежде всего чистый воздух. Сильно отравленный сероводород может вдыхать кислород. Иногда нужно использовать искусственное дыхание.
Хроническое отравление малыми дозами HjS вызывает общее ухудшение самочувствия, слабость, головную боль и др. Предельно допустимой концентрацией ВТС в воздухе производственных помещений считается 0,01 мг / л. Контейнер с ним должен быть белым с красными и» сероводородными » надписями и красной линией под ним. 25)кристаллогидрат HJS-GMjO может быть получен охлаждением насыщенного водного раствора сероводорода. Растворимость H2 $в органических растворителях значительно выше, чем в воде.
Например, 1 объем спирта поглощает 7 объемов сероводорода при комнатной температуре. Растворимость в расплавленной сере возрастает экспоненциально, когда она превышает 130 СС и достигает максимума около 350°С. По-видимому, это связано с образованием полисульфона. т. 26) В водных растворах сероводород легко окисляется йодом до свободной серы:12 + H2S = 2HI + S. И наоборот, в газовой фазе сера окисляет йодистый водород до свободного йода: S + 2HI-H2S + I » + 6 ккал. Ниже −50°C могут быть молекулярные соединения с составом H2S•12.
27) сероводородная кислота характеризуется константой диссоциации Ki — = I * 10-7 и / C2 = I•10 1.То есть он несколько слабее угля. Децинормальный раствор H2S имеет рН 4,1. 28) Помимо прямых и нейтрализующих реакций металлов и серы, обменное разложение с H2S или (NH4) 2S в растворе солей соответствующих металлов позволяет получить много сульфидов (плохо растворимых).
Раствор последней соли, который часто используется в лабораториях, обычно насыщают сероводородным раствором NH4OH (который производит NH4SH), а полученную жидкость готовят путем смешивания ее с равным количеством NHOHOH. (NH4) значение рН раствора 2S составляет около 9,3. С ’+ хох * * Ш — Ф ах. Существует гидролитическое равновесие. поскольку oio смещен вправо, раствор содержит очень мало ионов S «.
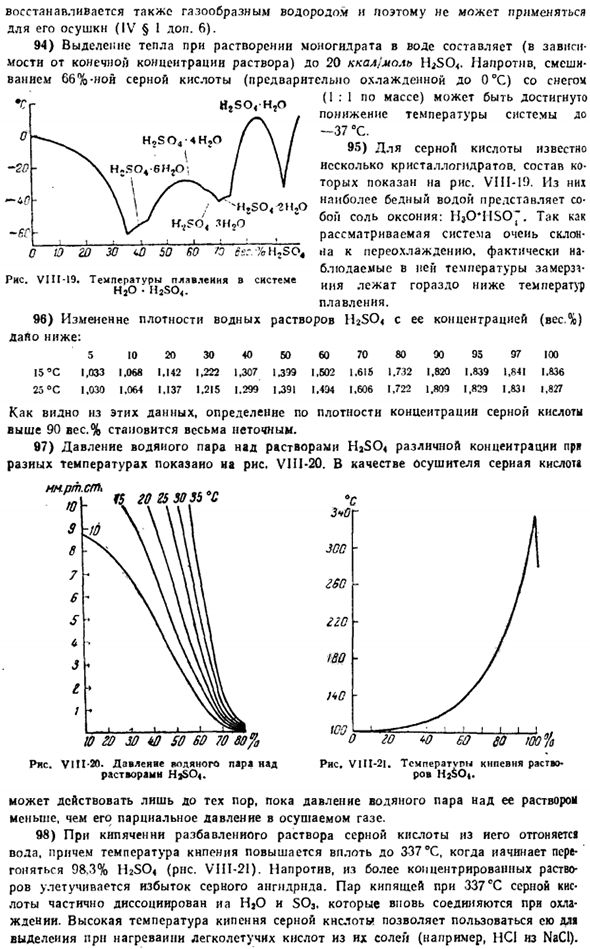
Таким образом, образование малорастворимых сернистых металлов при обменном разложении солей с сульфидом аммония протекает преимущественно по схеме(в случае двухвалентных катониалов): м2 * + Ш » * * МСН имеет меньше сульфидов МС-ФН и меньшую концентрацию ионов водорода. 29) систематический процесс качественного анализа катионов основан на различной растворимости соединений серы в отдельных металлах в воде.
Некоторые из последних(Na.К .Ва2 и т. д.) образуют водорастворимые сульфиды, в то время как другие части(Fe * \ Mn2 \ 2p2* и др.) не растворимы в воде, но хорошо разбавляют HCI, И. Наконец, 3-я часть (Cu2 \ Pb: \ Hg2* и др.) нерастворим в воде или разбавлен acid. So, сначала в кислой среде, затем в нейтральной или слабощелочной, он действует на раствор смеси сероводорода с положительным ions.
It можно отделить катионы друг от друга, а в каждом из них уже по отдельности и провести дальнейший анализ. 30) Что касается нагрева в отсутствие воздуха, большинство сульфидов очень стабильны. Раскаление в воздухе сопровождается переходом от сульфидов к оксидам или сульфатам. При температуре порядка 1200 ° С многие сульфиды восстанавливаются до металлов углем (по схеме 23S-fC= CS2-f23).
Имеется обзорная статья * о реакционной способности сульфидов. 31) к сильному раствору добавляют мелкоизмельченный сульфид серы, он растворяется с образованием соответствующего полисульфида (соединение Мио-серы), например: (k’H») 2S-f(l-1) S =(NH») 2S».Обычно смесь * Чаус И. С. качает второй. Ой.. Успех химика. 1969, м 797. Полисульфиды с различным содержанием серы. когда n увеличивается, цвет соединения изменяется от желтого до оранжевого и красного.
Наиболее распространенная сера этого типа соединения (NH4) 2S *также имеет сильный красный цвет Полисульфид аммония используется для полировки стали. смесь Полисульфида натрия в виде t. In печи из серы и Офера, используемые в кожевенной промышленности для плетения волос из кожуры. Печень серы для этой цели готовят путем плавления ссыра с содой.
Полученная зеленовато-коричневая масса растворяется в воде с сильной щелочной реакцией, а когда раствор еще стоит, он постепенно разлагается с развитием сероводорода. Некоторые органические производные полисульфидного типа используются в качестве горючего твердого реактивного топлива. 32) некоторые полисульфиды хорошо кристаллизуются (часто с кристаллической водой). в твердом состоянии они очень гигроскопичны и легко окисляются во влажном воздухе.
Образование полисульфидов также происходит при медленном окислении растворами солей серы и атмосферным кислородом, например, по следующей схеме: 4HS ’ — f 02 =2НаО-f 2sj.7. немного на них для защиты раствора (NH)) от образования polysulfides. it рекомендуется добавить p или Cu. 33) вылейте раствор полисульфида небольшими порциями в избыток раствора HCl, и желтое тяжелое масло собирается на дне резервуара. container.
It более или менее устойчив только в сильных окнах общей формулы H2S холодной среды, а при других условиях он разлагается с выделением серы. Очевидно, что могут быть сульфаны с очень большим значением n, и в отдельных состояниях будут получены все члены ряда вплоть до H2S».Они представляют собой маслянистую желтую жидкость с резким запахом. H2s2 положительный(Мп.-88, Мп.75°C, z = 1.17), H; S3 (Мп.- 529С), ВТС»(Мп.-85°C) лучше всего характеризуется. И H2Ss(Мп.-50°С).
34) молекулы сероводорода образуются на концах атомов водорода с зигзагообразной цепочкой атомов серы. По-видимому, такие цепи никогда не ветвятся (в отличие от углерода). Энергия связи S-S (63 ккал / моль) и S-H (83 ккал / моль) являются приблизительно постоянными для всех сульфанонов. Последняя является кислотой, и чем она сильнее, тем больше серы atoms. As можно видеть из данных следующего Na2S » гидролиз солей (0,1 и 25 ° с растворов): л…………… I 2 3 4 S Степень гидролиза. К. 。 85.4 64.6 37.8 11.8 5.7
Значение константы диссоциации равно H2S «(/Ci = 2 » IO » \ / C2-5•10 7 он определяется S8 (/C | = 4-I0 ’\ Kt = 3″ IO〜e).Сульфан более или менее легко расщепляется и растворяется в эфире и бензоле без разрушения. 35) дисульфан аналогичен по структуре перекиси водорода (IV§ 5 Add.7).Его молекулы характеризуются следующими параметрами: J (HS)= 1.35,</(SS)= 2.06 A, ZHSS = 92°, угол между связями H — S. Барьер свободного вращения связи S-S составляет 3 ккал {mol.
It жидкий бисульфитный водород хорошо растворяет серу, и растворение не влечет за собой образование высшего сульфана. Из природных соединений myogo серы, минеральный пирит (FeS2) является наиболее распространенным well-known. It представляет собой соли железа сероводорода. MnS2 также имеет аналогичную структуру (VII§ 6 add.35).
36) взаимодействие H2S с бромом в хлороформе может осуществляться путем образования бромистого водорода и тиобромидной кислоты по схеме Br2-f H2S * * HBg-f HSBr. При введении в систему сухого аммиака равновесие смещается вправо, так как получаются NHBR Br и NH SBR. Последние соли стабильны только при низких температурах, а при нормальных условиях они постепенно разлагаются на Br и S химические соли. Очевидно, что йод работает аналогично Брому.
Это особенно интересно, потому что йод не связывается непосредственно с серой. 37) некоторые свойства Галогенидных соединений серы сравниваются со следующими: СФ SJfIO sf8cl СФ » s2f, ок1 <scla Шачи, с Бк2 Физическое состояние, газ, газ, газ, газ, неустойчивая жидкость, жидкость. Цвет. ……..Благословенный и раздраженный. Что я должен сказать своему врачу, прежде чем принимать это лекарство? Нет, нет, нет, нет, нет, нет. Температура плавления Ния. С……. −50 (давление)-53 −64-121 −133 -Е0 −121-77-40 Температура кипения С……. −64 +29 −19 −37 + 15 (рвсл. Извините.+60 + 138 +57 (воег.(0.2 мм рт. ст.))
Большинство этих соединений образуются при взаимодействии элементов и легко разлагаются водой. 38) III питается, фторид серы образуется из элементов с высоким тепловыделением (289 ккал’, моль), он термически стабилен до 800°С. Его критическая температура составляет 38°С при критическом давлении 46 АТМ. Молекула «SF»неполярна и характеризуется высоким потенциалом ионизации(19,3»).
Его сродство к электронам оценивается в 34 ккал / ’ mol. In структура, это октаэдр с серой центр (d (SF) α= 1.66 A).Средняя энергия связи S-F составляет 77 ккал / моль. Для десорбции первого атома фтора требуется 86 ккал / моль(а второго-35 ккал / моль). jc(SF)= 3,6 (по другим данным-6,7).」 Поскольку церагексафторид менее растворим в воде, чем все другие газы (около 1: 200 по объему), он только не вступает в реакцию с раствором ионов, NaOH или HCl.
It разлагается с металлическим натрием только при высоких температурах(но быстро реагирует с жидким раствором аммиака при −64°c). SFe взаимодействует с водородом и кислородом, но при нагревании до 400 ° С при H»S реакция протекает по схеме. SFe + 3HjS-6HF + 4S. йодистый водород SFe легко разлагается в соответствии со схемой 30 уже SF6 + 8HI = 6HF + H, S-f 41. 39) фторид S2F10 является примесью к SFA в результате взаимодействия элементов (510 ккал / мес. тепло, выделяемое g).
Связывание неполярных (z = 0) молекул FsS-SF®задается длиной и силовыми константами S-S (2.21 A и 2.2), S — F (1.56 A и 4.3). что касается химических свойств, S ^ Fi©в целом аналогичен SFe. «o не инертен и высокотоксичен (больше, чем фосген).он медленно гидролизуется водой и быстро гидролизуется щелочью. 40) сера сера (тепло, выделяемое из элемента 184 ккал / моль, энергия связи SF 81 ккал / моль), например, 200-300°С при реакционном давлении: S + ’2C1a + 4NaF = «4NaCl + SF».Его молекула представляет собой полярия(г = 0.63), схема показана на РНС.
Деформированная трехугольная структура VIIM4.1. одно из его основных положений — это как бы заполнение парой свободных электронов атома серы. В отличие от инертного SFe, тетрафторэтилен является отличным фторирующим агентом, который может образовывать дополнительные продукты, легко разлагается под воздействием воды и является высокотоксичным.
CSSF был получен путем совместного нагрева CsF и SFA(под давлением).Его структура не установлена. 41) распространенным способом получения низкосернистых фторидов является их взаимодействие с АГФ при определенных условиях. Сообщалось о синтезе очень нестабильного голубого газообразного дифторида при очень низких температурах, и были определены несколько параметров молекулы SFj(d (SF) −1.59 A,< £ FSF = 98°, 1.051, это соединение не было выделено.
Бесцветная серия monophtho * (SjFj) также известна для 2 изомеров. это немного похоже на то. f’s ^ = d(SV*) = 7, e * A LF2SF2 * / 77° Рисунок VI 11 * 14.Молекулярная структура СФ». (mp 165, mp 11°C, q = 1.45), соответствующие выражению FSSF и структуре Гоша»параметр D (SS)= 1.89, d (SF)» 1.64 A. ZSSF » = 108°, угол между плоскостями SSF = 88°.Более устойчивая форма соответствует пирамидальной структуре формулы S = SFj и параметрам d (SS) −1.86,</(SF)= 1.60 A,^ SSF = * 108°и ZFSF-93°.
Оба изомера обладают высокой химической активностью. 42) хлорированная сера(SjCl2) образуется в больших масштабах путем прямого воздействия сухого хлора на избыток серы (теплота, выделяемая из элемента, составляет 14 ккал / моль).Дихлорид серы образуется при пропускании хлора через обратимую реакцию с S2Cla: SjClj + Clj * * 2SC1 .
В нормальных условиях он медленно разлагается на двуокись серы и хлор. Молекула SCIT имеет форму равнобедренного треугольника с атомом серы на вершине[d (SCI)= 2.00 A. a = 103°] 4 хлорная сера получается под действием жидкого хлора S2Clt. Это соединение является стабильным в твердом состоянии, а при плавлении распадается на SClj и CI. Некоторые продукты «SCI-attachment», например, SCI » — SbCI $(sublim. At 125°С) и др. в основном стабильны.
4 хлорная сера разлагается с водой с образованием S02 и HCl. 43) бромид серы получают из элемента (теплота получается 4 ккал / моль) (при нагревании) (в герметичной трубке).Под воздействием воды она разлагается в основном по следующим уравнениям: — SjBr, — f 2IItO = — 2HBr-f H2SjOt и H * S * Os + s: Br, «2HBr-f-4-SO» -f3S (прерывистое и немедленное разложение H2S-кислоты, Oj-само по себе неизвестно, но получены некоторые ее органические производные). это не. Аналогично происходит взаимодействие воды с хлоридом серы.
Последний, при хранении, постепенно разлагаются, сначала желтеют, а затем красновато-коричневые. Второй бромид серы менее стабилен(он разлагается при нагревании выше 90 ° С).Интересно, что хотя элементарная сера легко растворяется в S2Cl2 (около 1: 4 по массе при нормальных условиях), она почти не растворяется в S2Br*.в отдельных условиях получить соединения серы, содержащие йод, невозможно.
При совместном нагреве обоих элементов происходит только снижение температуры плавления системы(до 80°С с содержанием серы 65%). 44) структура хлоридов типа S2r * j и молекул сернистого бромида давно изучена. controversial. In кроме того, обсуждались формулы S = ST И Г-S-S-S-Г. Результаты структурного анализа поддерживают 2-ю интерпретацию: s;, CI (q = 1.06), и S2Brj аналогичны по структуре перекиси водорода (добавление IV§ 5.7) и параметру D (SS)= 1.97, d(SCI)= » 2.07 A. Для ZSSCl = 107° — S2CI2 и d (SS) −1.98. Если < / (SBr) «» = 2.24 A, ZSSBr = 105° — S2Br2.
Угол между плоскостями S-S-CI составляет 88°, а энергетический барьер свободного вращения-17 ккал / моль. Энергия связи s-C1 оценивается в 61 ккал / моль. Для константы силовой связи приведено значение k(SS)= 2.50. к(ОК1)= «1.99, х (СБР)» 1.43. 45) хлорид серы является отличным растворителем для многих соединений. Высокие значения констант cryostick (5.36 deg) и Evra (5.02 deg) подходят для определения молекулярной массы растворенных веществ.
Сама хлоридная сера диссоциирует (вероятно, по схеме S2CI2-f■f S2CI2 * * SjCI * — f S2C1〜), она незначительна, но в ее растворе может происходить выраженное образование такого продукта, как соль (например, HgClt-F S2Clj * * SJ •tclci * S, C£Sbclj** Hgclj-FCI). СБКИ〜).Также были получены некоторые твердые сольваты(например, 2cdo-S2Clj в розовом и Fe2 (So Alpha) 5•SjCl2 в сером).
4С) в резиновой промышленности хлористая сера (как растворитель серы) используется для низкотемпературной вулканизации резины и применяется для различных мелких взвесей. Большое значение имеет термическая вулканизация, которая осуществляется при температуре около 150°С с использованием элементарной серы.
Суть процесса вулканизации главным образом в it. It кажется, что атомы серы связаны двойными связями, присутствующими в нитчатых молекулах каучука, и эти молекулы»соединены» друг с другом. other. As в результате вулканизации он становится липким и легко теряет сырую резину в сыром виде»!Эластичный и эластичный на резине.
47) для серы, помимо описанных выше галогенпроизводных, известен близкий по структуре к общему типу S * r2 (то есть содержащий цепь атомов серы) миогенный сернистый водород. Где Γ-Cl или Br. Их обычно получают реакцией сульфана при низких температурах с избытком галогенированной серы или быстрым охлаждением продукта реакции путем нагревания паров S / G *водородом.
Очевидно, что могут быть молекулы SpT% с очень большим значением l. As эти теплотворные способности увеличиваются, образование хлорсульфана постепенно уменьшается(от 12 ккал {SjClj моль до S $ CI2 4 ккал /моль). в отдельных состояниях члены ряда вплоть до Sal *были помещены в карантин. Они имеют неприятный запах и представляют собой маслянистые жидкости различных оттенков оранжевого или красного цвета, которые в нормальном состоянии медленно разлагают S2r2-n-серу.
48) очень чистый хлорсульфан при особых условиях (разбавленный раствор, отсутствие света) конденсация H» C1 *и h2sm сульфана может быть использована для синтеза молекул серы кольцевого элемента, которые, очевидно, отличаются атомарностью. Например. S «HSH + CISSC1-f HSH-f образуется из H2S и SjCI2 по схеме CISSCI» 4HCI-F I 49) из сернистых соединений, содержащих кислород, низший оксид-оксид серы(S20) образуется под действием светящегося разряда на смесь S02 и паров серы при пониженном давлении(реакция протекает по общей схеме: S02-4-3S = *.= Сайт 2sao).
При температуре 1Г0°с выполняется давление 0,5 * * РТ С20 (теплота, получаемая от элемента 23 ккал! Удобнее получить а (мол).Искусство. Реакция по схеме: SOCIj-f 4-Ag2S-2AgCl-f BgO. Такое же соединение образуется по частям при сжигании серы с сильно уменьшенным потоком кислорода или при нагревании в вакууме мелкодисперсной пылевидной смеси CuO и серы (1: 5 по массе).
Раньше это считалось оксида Сокс (так или S202). Молекулы оксида серы соответствуют формуле S = S = 0 и имеют структуру неравностороннего треугольника: [d (SS)= 1.88,d(SO) α= 1.46 A, ZSSO = 118 eJ. Полярность (q =■1.47). кроме того, промежуточные атомы явно положительны по отношению к двум крайностям. Потенциал ионизации молекул S20 составляет 10,3 дюйма.
Оксид серы-это желтый газ, который может храниться в течение нескольких часов при комнатной температуре (в чистом сухом контейнере) только при давлении йода ниже −10 мм рт. ст. Искусство. Увеличивая концентрацию, реакция идет быстро: 2SaO-S02 + 3S. при сильном охлаждении оксид серы превращается в красно-оранжевое твердое вещество, а при нагревании до −30 ° C он разлагается на SO2 и серу (соотношение 1: 3).
S20 не окисляется молекулярным кислородом при нормальной температуре, но легко разлагается водой. Основным продуктом гидролиза является H2S202.Затем он вступает во вторичную реакцию. S20 реагирует более или менее легко с большинством metals. At при низких температурах было получено несколько дополнительных продуктов[например, желтый S20•N (CH3) 3].
50) структурные параметры молекулы SOJ (q = 1.63) известны с очень высокой точностью: ’c /(SO)= 1.4321 A и a = 119.536°.Эти цифры ясно демонстрируют потенциал микроволновой спектроскопии, используемой для их установления(III§ 6 постскриптум 9).Энергия связи s * * О-это константа мощности k = 10,0, 128 ккал! Предполагается, что это мол. Потенциал ионизации молекулы SOj составляет 12,7 b, а ее сродство к электронам задается значением 64 ккал / моль.
- 51) температура плавления диоксида серы составляет −75°C (теплота плавления).$ Ккал / моль), температура кипения −10°C (теплота испарения 6,0 ккал / моль).Критическая температура S02 составляет 78°C при критическом давлении 157 атмосфер. Термическая стабильность SO ^очень высока(по крайней мере до 2500 ° C).Диэлектрическая проницаемость жидкости SOj составляет e = 13 (нормальная температура) и смешивается со многими органическими жидкостями (эфиром, бензолом, сероуглеродом и др.) в любом соотношении. Она очень плохой проводник электрического тока.
Наблюдаемая незначительная электропроводность, вероятно, обусловлена незначительной диссоциацией по схеме: 3SO,^ SaOj * + SO^». 52) в качестве растворителя диоксид серы имеет интересную особенность. Например.
Хлористый водород в нем практически нерастворим, а свободный азот очень хорошо растворяется (кроме того, при повышении температуры его растворимость возрастает). Людмила Фирмаль
Элемент сера в жидкости так *нерастворим. Растворимость пода очень высока(при нормальной температуре по массе около 1:5), и раствор содержит в основном индивидуальные HjO molecules. It не имеет ничего общего ни друг с другом, ни с молекулами растворителя. В серии CI-Bg-I растворимость соединений галогена и фосфора быстро снижается, а галогенид натрия быстро увеличивается.
Фторид лития и натрия (не калия) более растворим, чем хлорид и бромид. Xef плавление well. In кроме того, полученный бесцветный раствор не проводит электрический ток. Напротив, солевой раствор обычно обладает хорошей электропроводностью(например, для Набр при 0°С имеется к = 5 * 10«*).Там почти нет жидкости S02(менее 0,1%).
Очевидно, то же самое относится и к свободным кислотам. 53) уже при очень низких концентрациях диоксид серы создает неприятный привкус во рту и раздражает слизистые оболочки. Вдыхание воздуха, содержащего более 0,2% так вызывает охриплость, одышку и быструю потерю сознания. Чувствительность человека к диоксиду серы очень различна, и она значительно снижается, когда вы привыкаете к нему.
Хроническое отравление диоксидом серы приводит к потере аппетита, запорам, воспалению дыхательных путей. Предельно допустимая концентрация S02 в воздухе промышленных объектов составляет 0,01. она считается ig / л. контейнер с баллоном so * должен быть черного цвета с белой надписью «безводная сера» и желтой линией под ней.
54) интересным отношением к диоксиду серы является растительный организм. Очень низкое содержание в воздухе (порядка 0,1 мг / М5) явно необходимо для нормального развития растений, но высокая концентрация оказалась очень вредной. Отдельные растения имеют различную чувствительность к S02.So среди деревьев, между елью и сосной-самый большой, а между березой и дубом-самый маленький.
Среди цветов розы особенно чувствительны к S02. 55) В дополнение к S02 в большом volumes. It используется для получения серной кислоты. Этот газ используется непосредственно в бумагоделательной и текстильной промышленности. При консервировании фруктов и ягод, для защиты вина от кислотности (оптимальное содержание СО *около 20 мг / л), дезинфекции помещений и др.
Для всех этих целей чаще всего их получают сжиганием серы. Последний горит в воздухе при температуре около 300°C. 56) дезинфекция жилищ диоксидом серы проводится уже очень давно. Интересно описание этого преинни(добавление 1§ 9). 57) давление цислазы на водный раствор очень велико, и содержание неизолированного H2SO в нем очень велико. Очевидно малое (соотношение (учитывая значение HtS0, J / lS02J, 5 * 10 «a). при охлаждении концентрированного раствора кристаллический гидрат S02-7H20 (mp 12°C), 2 + 4) обладает свойствами аддукта.
При нагревании SOJ с водой до 150°(в закрытой трубке) реакция протекает по схеме: 3SOa +2Н20= 2H2SO » + S. 58) серная кислота характеризуется константой диссоциации K \ 2•I0 ″ 1 и Kt = * = 6•I0_e. поэтому рассматриваются 2 структуры. Н — очь второй-оч / / о yS-O и > Sf \-<УУ ^ О Структура самой кислоты пока не ясна. Очевидно, что первая из них соответствует большинству его промежуточных солей, а вторая-некоторым инертным солям металлов.
Последние также, скорее всего, являются кислотными солями. Органические производные известны в обеих формах сульфита. SO ’ — ион имеет структуру треугольной пирамиды с атомом S наверху («(SO) » 1.53 L.^ OSO 105% 59) соль H2SO3 обычно получают взаимодействием SO «с гидроксидами или карбонатами металлов в водной среде. Практически наиболее важным является известный бисульфит кальция [Ca (HSOj) 2]из раствора, который потребляется целлюлозной промышленностью для извлечения лигнина из древесины, под названием „сернистая жидкость“.
60) при кристаллизации раствора гидросульфита натрия отделяют воду (по схеме: 2NaHSOj „=•Н204-Na: S2Os), натриевую соль (HjS2Os) пиреносфуровой кислоты в свободном состоянии получают formed. It удобнее получать натрий П И П О-сульфон в сухом виде (реакция 2S02 4-2NaHCO “- Na2S2Os 4-2CO » +4-Н * 0).Его разложение начинается уже со 100 * С, и протекает преимущественно по следующей схеме: NasS ^ Os = Na2SOj 4-S02.Пиросульфит натрия используется в качестве консерванта (консерванта) для влажных зерен и винограда.
Аналогичную калиевую соль (K2S2Os) можно получить в виде твердого бесцветного n-кристалла, который медленно растворяется в воде путем насыщения раствора KHSOj диоксидом серы. Он имеет название «stavisar fight» калий, который используется для окрашивания фотографий и fabrics. In в его водном растворе существует равновесие S3Oj ’ — f HrO < * 2HSOj, где концентрация обоих жрецов приблизительно равна.
Для калия, рубидия и цезия в твердом состоянии был получен не только пиросульфид, но и Н-бисульфит. 61) при нагревании сульфиты наиболее активного металла разлагаются при температуре около G00 * C, и образуются соответствующие соли серной и сероводородной кислот. Пример: 4K: SOj-3K2S04 4-K2S. этот процесс подобен образованию перхлоратов и хлоридов во время раскаленного добела хлората.
62) из процессов, не связанных с изменением валентности серы, реакция добавления SO2 имеет практическое значение. HjSOj и его соли и некоторые органические substances. In в частности, это относится ко многим красителям, и полученные аддукты почти бесцветны или слабо окрашены. Это является основой для использования S02 (обычно это раствор) для отбеливания шерсти. Шелк, солома и др., т. к. материал не терпит отбеливания сильным окислителем.
63) значение серы не изменяется с переходом от SO2 к Галоиду (SOr2).Наиболее важным из них является тионилхлорид, который получают, например, по следующей реакции. SOj■+ SCI2 SOCI * + 50″. Молекула osci2 полярна (q = 1,44) и имеет форму треугольной пирамиды с сернистым аием на вершине [«(SO) — I. 44. «(SC1) „2.08 A, ZOSCI * =107®,^ ClSCl 96“ 1.Для константы прочности связи приведены значения k = 11.0 (SO) и K» 3.8 (SC1).Тионилхлорид-бесцветная жидкость.
Едкий запах(Мп.-100. КД.76°C) при нагревании выше температуры кипения он разлагается на S02, SjCI * n Cli. Диэлектрическая проницаемость жидкости SOCl2 составляет ε «9 (при комнатной температуре) и диссоциирует лишь незначительно(вероятно, по схеме: SOClj 4-SOCI2 * * SOCI * 4-SOCI»).Oi плохой растворитель для солей TPN. Под действием воды происходит хлорирование! Тионил полностью разлагается за счет образования серной и соляной кислот: SOCIt +• — F2н20h2sos4-2НС1.Используется при изготовлении красителей, лекарственных препаратов и др.
Осадка металла из кристаллографии (например, CuCI2•2НаО4-2soc1″=».- 4HCI * 4-2SOjf 4-по схеме CuCl2). В дополнение к SOCI были получены следующие соединения этого типа: бесцветный софт(c 1.62. Mp. −129, mp.-44°C) и SOFCI (mp.-137, Мп.12° C) и оранжевый СОБР, (q1. 47.Mp. — 52, mp. 138°C). в случае тионилфторида параметры » (OS) 1,4 1,41, ((SF) 1,5 1,59 A, ZOSF-SO,^ FSF 93* и SOFCI приведены Очевидно, что есть 2 isomers.
At нормальная температура, oi медленно сломлена вниз в мягкое и SOCI. 64) MF + SO2-MSOjF согласно схеме, при длительном взаимодействии жидкого диоксида серы с фторидами Cs, Rb, K и Na (кроме Li) образуется соответствующий сульфонат фтора и структура напоминает хлорит. Теплота, получаемая при вышеуказанной реакции солей цезия, рубидия и калия, составляет 23, 21 и 18 ккал / моль соответственно.
Температура плавления свободной фторсульфиновой кислоты (HSOjF) составляет −84°C, но она присутствует только в смесях жидких SO2 и HF (полностью смешивающихся друг с другом).При нагревании или под воздействием воды фторсульфинаты разлагаются. 65) в присутствии большого количества воды взаимодействие SO2 и HjS очень сильно difficult. In кроме свободной серы, образуется смесь сульфандифосфоновой кислоты общей формулы H2SnO, обычно называемая политионовой.
Атомы серы вступают в непосредственный контакт друг с другом, образуя цепь. Согласно этому, например, тетратионовая кислота соответствует структурной формуле HO_SOj_-S_S_S02_OH. Не — S40 * — пространственная структура показана на рисунке. VII1-15. В водных растворах политионовые кислоты сильно диссоциируют и слоятся (очень медленно при нормальной температуре) Разработка HjSO ^, HjSOj и free sulfur. By себя самого Они совершенно нестабильны сами по себе, но бесцветные диэфиры могут быть получены взаимодействием сульфатов в эфирной среде с безводной серной кислотой по общей схеме: H2S» + 2S03 + 2(H22H5) 20 = 2OJ•2(С2Н5) 20.
В отличие от свободных кислот, политринонат калия, который изучен лучше, чем другие соли, очень стабилен (от n до 3-6).Все они легко растворимы в воде (примерно 1: 4 по массе) и нерастворимы в спирте. Непрерывная миграция n по ряду 3-6 улучшает стабильность полинонатов в кислой среде, но быстро деградирует в щелочной среде.
86) основные процессы взаимодействия SO1 и H2S в водной среде можно объяснить следующей схемой: S02 + 2H2S-21120 + 3S S02-fHjO + S = H2S, 03 3ТАК «+ Н2С-Н2С» Оэ 3S02 + ч * с-Ф С-HjSsOe Первым полученным промежуточным продуктом является образование тиосульфуровой кислоты, которую можно получить по схеме H2S■+ * — f S02 = H2S202 при-70°С. Но при нормальных условиях исходный газ разлагается. Общие схемы H2S » Os-f H2S203 xt H2Sn4i06 + h2s03 замена rpynnhs03〜и S2Os-может привести к образованию полинонатов с различными значениями n. It следует отметить, что процесс образования политионовой кислоты имеет и другие интерпретации. Существует монография*по этому вопросу.
67) при получении раствора отдельных политионовых кислот они обычно исходят из калиевой соли и разлагают последнюю с точно рассчитанным количеством кислоты, образуя нерастворимую калиевую соль (например, HC10 -).Общим сырьем для производства самого политриноната калия является его тиосульфат-Кжсфо. Реакция их образования протекает по формуле. 2K2SjO,+ 3S02 «2K2S30 * + s 2K: S> 0, — f I2 = K2S» Os-f 2KI 2K2: SA + SCI,= K, S505 + 2KX1 2KjS20j + S, Cla-K506-f 2KCI * Volyskja H. P, Полтконаты тиоселевой кислоты. ответ максиродера. М. «Наука», •мил, 79 секунд、
Для получения тетраэдрата калия удобнее обрабатывать его непосредственно из смеси флюсовых кислот, образующихся в результате взаимодействия SO2 и H * S. после фильтрации серы в жидкость добавляют ch3cooc и crystallized. In в этом случае сначала будет выделяться K2sosos (призматический Кристалл), затем kjsso»(Кристалл в виде пластины).
Очень чистая соль устойчива при хранении, но соли, загрязненные примесями, разлагаются. 68) высокий поли (L> 6) менее стабилен и не изучался. Для некоторых из них (H2SisOe и др.), были выделены соли со сложным составом известковых катионов. Длина зигзагообразной цепи серы в Флюксионной кислоте, а также сульфана и галогенированного сульфона в основном не ограничена. Однако с увеличением n стабильность уменьшается.
69) тионовая кислота (H2S20«), известная только в растворе, несколько отличается от общей тионовой кислоты, упомянутой выше. Он не содержится в продуктах реакции so) и H2S, но его обычно получают из солей марганца. Последний образуется по формуле Mn02 + 2SO2 = MnS * 0 при пропускании диоксида серы через воду, содержащую гидрат диоксида марганца.
После обменного разложения с Ba (OH) 2 и отделения осадка (BaSOj и Basoa образуются параллельно с основной реакцией), бесцветные кристаллы BaS20e-2H20 могут быть отделены от solution. It действует на последнюю соль с точно рассчитанным количеством H2SO.«
Раствор свободной днтноновой кислоты легко доступен. При попытке сильной концентрации происходит разложение по следующей формуле: H2S2Oe= H2SO» — f-S02.Что касается окислителей, то дитионовая кислота гораздо более стабильна, чем другие члены ряда. Большинство солей хорошо кристаллизуются, все растворимы в воде.
Структура азотной кислоты соответствует формуле HO-S02-S02-OH, а расстояние d (SS)= 2,15 А. 70) Zn-f 2SOs * = — обрабатывая газообразный диоксид серы водной суспензией цинка в соответствии со схемой ZnS20, он образует цинковую соль дитионовой кислоты, которая не отделяется свободной (иначе-рН обезвоженной и стабильной) кислотой (H2S20). При осаждении ZN Na2CO *и добавлении NaCl к фильтрату выделяется бесцветный кристаллогидрат Na2S20-2h20.
Поскольку солевой раствор нестабилен, он обезвоживается при нагревании вместе со спиртом. Относительно стабильный безводный донтоинт (иначе-гидросульфит) натрия растворим в воде (1: 5 по массе).Раствор очень разбухший. Кислород растворяется и используется для окрашивания тканей в качестве сильного восстановителя (окисляется до сульфита или сульфата).
Диснонит натрия можно также получить взаимодействием амальгамы натрия при температуре менее 10°С с насыщенным спиртовым раствором S02. Как Na2S/).»Другие соли ионных кислот и активных металлов бесцветны, хорошо кристаллизуются, легко растворимы в воде (кроме CaS20) и характеризуются сильным восстановлением properties.
In растворы (причем в виде кристаллогидратов) все они нестабильны. Распад протекает в основном по схеме: 2С?0 ’«= С 0 *—ф С20* -. Свободный H-S20 «является кислотой средней прочности (/ C | = 5 * 10» / C2 = 4 * 10 ″ 3) и очень нестабилен. Даже разбавленные растворы постепенно разлагаются и легко окисляются кислородом воздуха. По-видимому, как и в случае сульфита, возможно наличие 2-х форм:
Но о нем II R II II С-С и Х-С-С-Х ВТОРОЙ ВТОРОЙ ВТОРОЙ ВТОРОЙ ВТОРОЙ ВТОРОЙ 0, 0, 0, 0. Мой S/) J-состоит из 2 групп SOJ, Соединенных очень длинной-2.39 A-связью S-S. 71) реакция CoS20 по гидросульфату, начиная с кобальта+ + 2NaHCOs = Na2so J + — f CoS02 4-2C02-f H20, получается в виде коричневого кристаллогидрата сульфоната кобальта Co-02-3H20[более вероятно. Co2 (S02) 2•6H20], соль Сульфоксильная кислота (H2S02).
Для последнего возможны следующие структурные формулы: Хо-с-О и Хо-СФ н Сама кислота, образующаяся в качестве промежуточного продукта при гидролизе SC1*, очень нестабильна (разлагается в основном по схеме 2H2S02 =Н20+ H2S2Oj). кроме вышеуказанного кобальта, наличие других солей достоверно не установлено. В то же время было получено несколько органических производных сульфоксильной кислоты.
Из них кристаллические соединения, содержащие формальдегид в составе NaHSOa * * HCNO•2H20 (mp 63°C). Известный как йод под техническим названием «Ронгалит», он используется в качестве сильного восстановителя(обычно для удаления красителей из ткани).Это вещество хорошо растворяется в подине (1: 2 в массе), устойчиво к щелочным и нейтральным средам и проявляет только восстановительное свойство около 100°C.
In с точки зрения структуры, ронгалит получают из 2-й формы вышеупомянутой сульфоксильной кислоты путем замены гидроксигидроксила натрием и водорода, связанного с серой с радикалом CHjOH. 72) окисление HjSOa и его солевого раствора кислородом воздуха сопровождается ультрафиолетовым излучением с длиной волны около 2200 л.
Этот процесс, по-видимому, является цепной реакцией, а появление цепей связано с каталитическим действием примесей. Это обстоятельство говорит в пользу того, что чем медленнее скорость окисления, тем тщательнее очищенная вода берется для растворения. Напротив того. При добавлении в раствор следового количества Fe, Cu и других солей он значительно увеличивается.
С другой стороны, окисление сульфитов кислородом воздуха можно свести практически к нулю, добавив небольшое количество спирта, глицерина, SnCl2 и др., к решению проблемы. Иногда это явление действительно используется в производстве органических препаратов. 73) из отдельных процессов окисления сульфита особого упоминания заслуживает реакция с НСА, а зависимость скорости химического взаимодействия от концентрации и температуры можно наглядно проследить observed.
In сумма, она может быть представлена формулой HIOj-f-3h2so J = 3H2S04-f HI. In дело в том, что реакция идет по этому прямому пути только в первый момент, а после того, как в растворе появляется HI, параллельно протекает следующий процесс. NLA + 5HI = 31 ″+ 3H, 0 и 312 + 3H2SOj-f 3H20 = 3H2SO4, — f 6HI Из них 2-й быстрее 1-го. поэтому йод может появиться в растворе только после того, как сернистая кислота полностью окислится.
Этот момент определяется синим цветом крахмала, добавляемого в смесь. Реакция, о которой идет речь, интересна во многих отношениях. Сначала мы покажем пример цепной реакции, которая протекает в растворе. Процесс по первому выражению создает цепочку, а процесс по обоим следующим участвует в цепочке. development. It затем можно использовать в качестве примера самокаталитической реакции (VII§ I ext.22).
Это происходит потому, что ионы G, образующиеся в процессе, ускоряют весь процесс(это можно легко установить, добавив немного KI к исходной смеси).Наконец, с другой стороны, удобно проследить действие так называемого отрицательного катализатора-вещества, которое при добавлении в небольших количествах значительно снижает реакцию rate.
In в данном случае таким веществом является HgCI3.При добавлении в смесь процесс значительно замедляется. 74) согласно схеме, можно получить свободную сернистую кислоту путем взаимодействия сероводорода с хлорсульфоновой кислотой при −78 ° C. HSOjCl-f H2S = HCl | + — hjs203.Когда он охлаждается жидким воздухом, это маслянистая жидкость, которая затвердевает в стекловидную массу. Выраженное разложение хлорноватой кислоты (по схеме.2HaSaOj= H * S t-f Hjsoe) также происходит при −78°С.
Замечательно стабилен его диэфир-H2S203 * 2 (С2Н5) 20.Коллапс (на H2S, S03 и эфире) — 5CC и выше только. SaO * — ион имеет тетраэдрическую структуру с 1 атомом серы вокруг своего центра и еще 1 вокруг него («/(SO)= » 1.48.< / (СС)= 1.97 А].Для константы прочности связи k (SO) » = 7,0 и(SS)= 2,9.
Результаты определения 2-й константы диссоциации хлорноватой кислоты (КТ-2 «10) свидетельствуют о том, что она несколько сильнее серной кислоты (/С 1•10»*).Na2S20 ″ при подкислении раствора HS, Oj — ►HSOs-f S уже около p! Происходит при 1 = 4.5.Когда раствор Na2S20$опускают в кипящий концентрированный ISC, hjsoa-fMaO ^.= Согласно схеме Li2S + ibS04, серийная кислота разлагается. 75) интересна химия получения гипосульфита взаимодействием серы и щелочи.
Эта реакция на первой стадии протекает так же, как и одновременное окисление и восстановление серы, а именно с соответствующей галогенной реакцией: 3S4-4-finaoha= Na2SO $ 4-2Na2S-f 3H20.In в свою очередь, избыток серы связывается с Na2SOj с образованием hyposulfite. In параллельно происходит образование полисульфоната натрия, который придает раствору желтый цвет, occurs.
To разрушают их с образованием гипосульфита, Сож пропускают через раствор до тех пор, пока жидкость желтого цвета не исчезнет. 76) еще один интересный способ получения гипосульфита основан на прямом взаимодействии S02 и H2S в щелочной среде. Пропуская смесь обоих газов до нейтрализации при сильном перемешивании в растворе NaOH, образуется гипосульфит: 4S02 4-21 US 4-6NaOH-3Na » S » 0 ″ — f 5H20. При температуре 48,5°с гипосульфит растворяется в кристаллической воде и примерно на 100% теряет воду.
Дальнейший нагрев соли выше 220°С повлечет за собой ее распад. В основном это делается по схеме: 4Na2S20j = 3NajSO «4-Na2S *и Na ^ Sj =» Na2S-F 4S. расплавленный гипосульфит очень склонен к переохлаждению. Иногда его используют в качестве среды для определения молекулярной массы путем понижения температуры замерзания (постоянная замерзания 4,26 градуса).Наиболее интересным среди других тиосульфатов является малорастворимый (2 г / л) Басао.
Метаболическое расщепление сульфатами различных металлов удобно использовать для получения тиосульфата. 77), а также свободный хлор, другие сильные окислители (HOCI, Br2 и др.) окисляют гипосульфит до серной кислоты и ее солей. В противном случае, то есть с образованием соли тетратионовой кислоты, происходит окисление следующего сульфита относительно слабым (или медленно действующим) окислителем, особенно йодом:12 + 2. \ fa2S203 = 2NaI + XasS4Oe.
Эта реакция очень важна для аналитической химии. Это связано с тем, что он лежит в основе 1 из наиболее важных методов анализа объема, так называемой ioOometry. Отметим, что в щелочной среде окисление гипосульфита йодом может перейти в сульфаты. 78) медицинское применение гипосульфита очень diverse. It вводят внутрь (или внутривенно) при отравлении тяжелыми металлами, мышьяком, цианидом и дезинфекции кишечника.
Тяжелые ожоги и воспаление кожи требуют внешнего (или внутреннего) воздействия use. To лечение 癬, кожу пациента несколько раз протирают концентрированным раствором Na2S20 с последующим растиранием разбавленным раствором соляной кислоты. 79) ближайшим аналогом H2S20 является «H2S-0-политиосульфат» (n = 3-7), который обычно получают в эфире при −78°c! Схема: H2S * 4-SO 4-(С2Н$) 20″ » H2S* + | 0 | •(C2H*) АО. Они легко растворимы в эфире и имеют очень выраженную кислую природу, но только одно основание (в отличие от H2S20j), что соответствует структуре сульфамойосульфоната H — Sa — i — SOjOH.
И сама кислота, и ее соли разлагаются водой. 80) Camp brain является отличным катализатором в синтезе вольфрилата (mp.-54, Мп.69 СС). 02SCI2 молекулы полярия(м-1.80), пространственная структура которых соответствует параметров D (именно так) » = 1.41 а, ZOSO =123®, д (ТСМ)» в 2.01, zc1sci-100°, нерегулярные тетраэдра. При нагревании выше 300°C сульфурилхлорид распадается на S02 и С12.
Oi является подходящим растворителем для SOJ и большинства хлоридов поливалентных металлов. Взаимодействие Такой раствор будет служить удобным способом получения соответствующего безводного сульфата. n = 2 (Мп.-37, депутат.152°с), n = 3 (Мп. Общая формула S * Ojn-iCla (-19°C) и n = 4 (бесцветный) также известна как полисульфонилхлорид. Жидкий.) 81) соответствующие оксо-хлоридные производные серы, бромида и йодида неизвестны. Напротив, фторид хорошо изучен.
Сульфурилфторид (S02Fj) образуется при непосредственном взаимодействии S02 и F2, но для инициирования реакции (например, путем введения раскаленной платиновой проволоки в смесь газов) необходимо boosted. It удобнее получать его действием фтора при температуре, превышающей 100°С, на безводный сульфат натрия (реакция протекает по формуле Na * SO 4 * 4-2F2 = 2NaF 4-S02 4-Og). Молекулы 02SF2 полярны (q-1.11) и имеют тетраэдрическую структуру с атомом серы вблизи центра(J(SO)= 1.41 A, ZOSO = * 124°,d(SF)= 1.53 A, ZFSF =96е«].
Сульфурилфторид представляет собой бесцветный газ (Мп.-136 куб. см, то есть очередь −55°С), и химически очень инертен. Поэтому он не взаимодействует с водой (даже при 140°С). он разлагается в щелочном растворе, растворимость в воде относительно мала(1:10 по объему), а в спирте она значительно больше, и пиролиз SOjFj начинается только при 400°С и выше.
82) оксо-фурид также известен: SOF4 (mp.-100.Mp. — 49X). (SF) АО (mp −115, mp.31°С), S2OsF | (Мп.48.Мп.51°C) и других распространенных видов полисульфидные фторид SOnFVnSO (до N = 6), S03Fj(Мп.- 158.Мп.-31 ЕС), Софэ (Мп.-86. тп.-35°С).2 из последних является производным фторциклической кислоты, водород которой связан с радикалом S () 2F или SF.
Длина соединения SFjOF выглядит следующим образом: d (SF)= * 1.53. д(Так) −1.64. rf (OF)= 1.43 A. Летучий сульфат(F $ S) 2 $ 04 (т. кипячение.94®С) интересно. Также был получен смешанный Галоид охало: SOaFCI (mp.-125.Mp.7°C), SiOsFCl(mp.- 65, Мп.100°с), Sojffr(Мп.-86.Т. Кипятить.40°С). 83) молекулы OSF4 аналогичны по структуре SF4 (рис. V11I-I4). кроме того, атом кислорода занимает место пары свободных электронов (</(SO)= 1.42 d(SF)= 1.55(2)и 1.58(2) A, ZFSF =123е и 181е).
Когда OSF4 приводят в контакт с избытком ликвора при 100°C в течение 1 часа, образуются CsOSF *это. Особенности этой интересной соли до сих пор неизвестны. Под влиянием Ft, он легко передается в CsF и FOSF. При температуре 210°C этот оксофторид разлагается на SFe и кислород. 84) хлорсульфоновая кислота (Мп.-80°С) неустойчив и очень трудно получить в чистом виде. Технические изделия обычно имеют темный цвет. Для ионов SOjCl приведены следующие значения силовой постоянной: k (SO)= 8,0 и k(SCI)= 2,8.
Хлорсульфонат может быть получен путем воздействия SOa в растворе или суспензии хлоридов металлов в жидком SO2.Там нет обработки такой подвески! Ко производит бесцветные кристаллы Naci-3S05 и KCI•2S03, нагретые до 170°C, а затем имеет состав MCI * SO. MS03C1 представляет собой хлорсульфонат. Когда Жидкий SOj добавляется к раствору A1C13, белые кристаллы AlCIj * 3SOj осаждаются в S02.
Вероятно, представляет собой хлорсульфонат алюминия-AI {SOjCl) 85) аналогично хлорсульфону. Фторсульфоновая кислота-текучая, бесцветная жидкость(т.- 87.Т. Кипятить.163°с).Курение в воздухе. Soj и ВЧ(паровой фазы ВЧ + найти в? Он легко образуется при взаимодействии (I * HSOjF4-23 ккал) и медленно гидролизуется с водой по схеме: SOa (OH) F4-Н20** 1 если 4-Хасо.«
Из-за обратимости этой реакции(ее константа равновесия равна 0,12) смесь концентрированных HF и H * SO содержит значительное количество HSOjF», — сказал он said. In отсутствие влаги вообще, фторсульфокислота не действует на стекло и большинство металлов и бурно реагирует со многими органическими веществами. Он растворяет фторид AgF и некоторые другие элементы.
Отличительная особенность кислоты более выражена во фторсодержащей кислоте, чем в серной. Именно поэтому соли многих металлов известны и, как правило, слабо растворимы в воде (но растворимость CsSOjF при 0°С составляет всего 0,1 моль; л).Получите его нормально. S03 непосредственно связан с соответствующим фторидом (при нагревании).Из производных наиболее активные производные одновалентного металла плавятся без разложения (например, KS03F с ZM ^ C).
Приблизительно при 500 ° С фторсульфонат бария разлагается по формуле Ba (S03F) 2-BaSO <4-S02B2.Эта реакция служит удобным способом получения фтористой серы. Для Иона S03F задаются следующие значения диапазона и длины постоянной силы: «(SO)= 1.43, » (SF)= 1.58 A. от (SO)= 8.0 и k (SF)= 4.7. Среди других фторсульфонатов, FXe0S02F следует в первую очередь остерегаться кристаллов с «(FXe)= 1.94″(XeO)= 2.16. «(ОС)= 1,51. «(Так)= 1,42.»(SF)= 1.53 A. ZFXeO = 178°. ZXeOS = 123°.
Интересны производные положительных галогенов, образующиеся при взаимодействии молекул G2 с S206F2 (add. См. 119).ISOjF (mp 52°С) и I3S03F (mp 92 °ddecomp) в черном цвете. В нормальных условиях жидкость имеет красно-черный цвет BrSOjF (mp 200°C).Светло-желтый C1S03F(mp.-84.mp. 45°C).Оранжевый Br(S03F) 3 (mp 59°C).Желтый l (S03F) 3(mp 32cC). 102S03F, IF3 (SO> F);.
Бесцветные KI (S03F)»и KBr(S03F)«.Желтый Нелетучий Re03S03F находится рядом с производным йода (mp.-33°С).Интересны также ковалентные производные серы-SFA(0S02F) 2 и SF4 (OSF) 2.Также светло-желтый S «(S03F) 2.Все эти вещества гигроскопичны и быстро разлагаются водой. Фторсульфоновая кислота в основном используется в органическом синтезе. Взаимодействие с перхлоратом калия при нагревании (согласно уравнению КСУ »+ 4-HSOjF = KHSO » 4-FCI03) служит способом получения фторхлорэтилена (VII§ 2 add.68).
86) другой 1 аналог HS03C, бромсульфокислота (HS03Br), была получена путем насыщения раствора S03 жидкости S02 сухим HBg при −35°C. It представляет собой светло-желтое вещество, которое разлагается при температуре около 7 ° С и разлагается на H2SO2, SO2 и Br2. 87)с S02 при сжигании серы в воздухе. n S03 образуется, но пропускает только менее 4% поглощенной серы there. In помимо реакции, показанной в тексте, триоксид серы может быть получен пиролизом NajS ^ y или безводного Fe2 (SO«) 3.
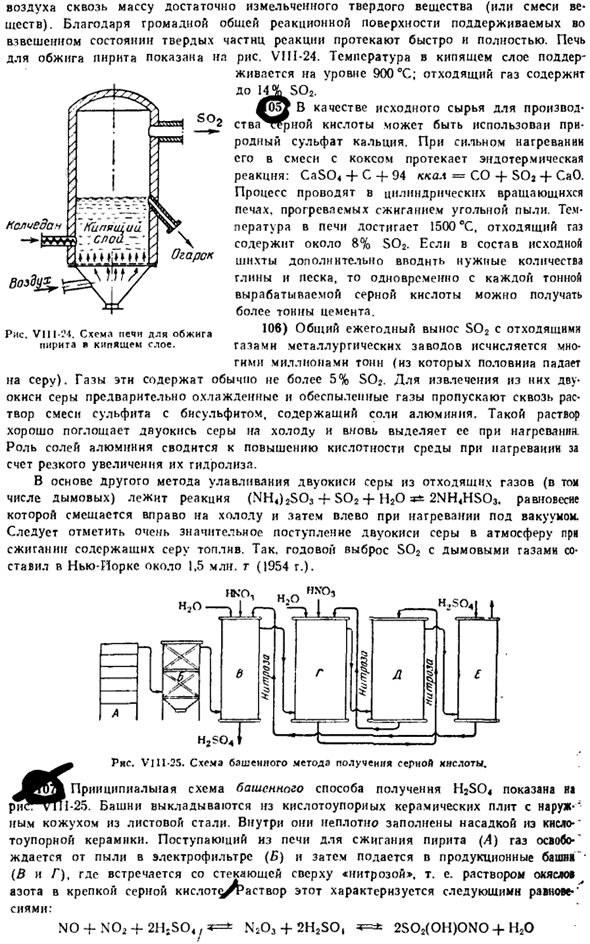
Из-за взаимодействия S02 с озоном образуется очень чистый S05. 88) SO * молекула неполярна и имеет плоскую треугольную структуру с атомом серы в центре («(SO)= 1.41 A].Если энергия и сила связи постоянны S » = 0, то 113 ккал / моль и k даются в виде 10,8. Безводный пар серы (и его раствор S02) состоит в основном из молекул S03.С другой стороны, в жидком равновесии 3S03 * * перемешивается вправо** (С03)3.Молекула тримера представляет собой кольцо (рис. VII1-16), образованное чередующимися атомами S и O (среднее расстояние) Рисунок VI11-17.Принципиальная схема lS03)( Рисунок VII Мб.
Структурный чертеж (03 USD) 3. ’п’- «(S-O)= 1,61 и » (S = 0)= 1,35 A].Безводная серная кислота стекловидного типа α (mp 17°C) состоит в основном из этих кольцевых молекул. Основой структуры других форм твердого тела является зигзагообразная цепь с более или менее значительным числом звеньев-S (02) — 0S(02)-O(рисунок VIII-I7).По-видимому. отделенный от Одина другого в p-типе (mp 32°C) и сваренный к плоской решетке y-типа (62°C под давлением) или 6-типа (структуры MP Навальной) (под давлением mp 95°C) все изменения безводной серной кислоты высокое давление пара и легко sublimated.
It следует отметить, что очень трудно получить различные формы твердой безводной серной кислоты в чистом виде, которые обычно требуют решения Их смесь. Аналогичные смеси продают лекарственные препараты (белые кристаллы). Наиболее удобным для хранения и транспортировки в больших количествах является серный ангидрид в виде жидкости (т.43°с).Это только стабилизирует, полностью удаляя даже самую малую влагу.
Стабилизация Ce достигается введением специальных добавок (SOCl2, B203 и др.). 89) под действием распыленной серы против жидкости S03, которая также тщательно защищена от следовых количеств воды, образуются кристаллы зеленовато-голубого дихлорида сернистого осадка (S203).Этот оксид очень нестабилен сам по себе и разлагается, как только выделяется сера.
Естественное разложение при комнатной температуре протекает в основном по схеме: 2S203 = 3S02-fS. Его структура ответственна. Вероятно, формула OS = $ 02. 90) моногидрат получают кристаллизацией концентрированной серной кислоты при −10 ° С. молекулы (H0) 2S02, образующие его кристаллы, соединены между собой достаточно сильным (6 ккал / моль) водородом bond. As схематично показано на рисунке. VIII-18. (H0)2S02 сама молекула имеет искаженную тетраэдрическую структуру с атомом серы вблизи ее центра и характеризуется следующими параметрами:®С с теплотой плавления ККИ / mol.In нормальные условия, это сильно вязкостная жидкость、
Очень высокая диэлектрическая проницаемость (при 25 ° C e = 100).Незначительная собственная электролитическая диссоциация моногидрата протекает параллельно в 2 направлениях[HjS0J] [HS07] = = 2•10 «4 и| H304] [fHSj07] = 4 * 10″ 5.Его молекулярно-ионный состав характеризуется почти следующими данными (%): H2S04 hs07 H3SOJ » n, o * n $ ao-H3S3O7 99.5 0.18 0.Н 0.09 0.05 0.04 Даже при добавлении небольшого количества воды диссоциация по схеме становится доминирующей: 11.0-f H,$ 04 ^ H30 + + HSO;.
92) моногидрат является кислотным ионизирующим растворителем.Сульфаты многих металлов хорошо растворимы в нем(превращаются в бисульфаты), но соли других кислот обычно растворимы только тогда, когда возможен сольволиз(превращаются в бисульфаты).Поведение яблочной кислоты Моногидрат как слабое основание (HM03-Ф 2H2S04; » краны закрепительных втулок H30 * + не * — Ф 2HSO3) Ф хлорная кислота-очень слабая кислота| Н ^ 04 + ISU4 HjSO ^ +С107].
Было обнаружено, что фторсульфоновая кислота и хлорсульфоновая кислота являются несколько более сильными кислотами(HS03F> HS03CI> HCIO4).Моногидрат часто растворяет многие органические вещества, в том числе атомы с неделимыми электронными парами(которые могут связывать протоны).Некоторые из них могут быть восстановлены в исходное состояние только путем разбавления раствора водой. Моногидрат имеет высокое значение для криогенного колита (6.12 e) и иногда используется в качестве среды для определения молекулярной массы.
93) серная кислота действует как окислитель и сводится к СОА. Однако, он может быть уменьшен к S или H2S самым мощным разбавителем. Концентрированная серная кислота реагирует с сероводородом по следующему уравнению: HjSO «+ H2S = » 2H20-f-SO * — fS. Ч АЛЬФ ’» вт ср СР «Я?」- Рисунок V1IM8. Схема водородной связи кристаллов M2SO4. rf (S = 0)= 1.43 A. ZOSO = 119. Его нельзя использовать для сушки, так как он также восстанавливается газообразным водородом(IV§ 1 дополнительный 6). 94) температура при растворении моногидрата в воде составляет до 20 ккал (в зависимости от конечной концентрации раствора)!Моль Ч * S04.
Наоборот, путем смешивания 66% серной кислоты (предварительно охлажденной до 0°С) со снегом (1: 1 по весу) достижимо Ч, значит » Н? О Ниже −37°С. 95) для серной кислоты известно несколько кристаллических гидратов, состав которых показан на рисунке. VIII-19.- Из них, — сказал хьомисо, — вода самая скудная: оксониевые соли.«Рассматриваемая система очень склонна к переохлаждению, поэтому фактическая наблюдаемая температура замерзания значительно ниже температуры плавления.
96) концентрация водного раствора концентрация H2S04 (мас.(% ) Изменения, вызванные: 5 10 20 30 40 50 60 70 80 00 93 07 100 15°Х1.033 1.068 1.142 1.222 1.222 1.307 1L99 1.602 1.615 1.732 1.820 1.839 I. S4I 1.8362®С1.030 1.064 1.137 1.215 1.299 1.391 1.494 1.606 1.7221.091. 829 1.831 1.827 Температура системы Как видно из этих данных, измерение плотности концентрации серной кислоты выше 90% по массе является очень неточным.
97) давление водяного пара раствора hjs04 с различной концентрацией при различных температурах показано на рисунке. VIII-20.As осушитель, серная кислота » это хорошая вещь. croA^лгтпт [9 /% ю oO2D 30 < 0 50СО Диаграмма VIII-19.Точка плавления системы Н20 * HaS04. −20 4HtSO «2HjO K. SO» ли, о _Я — Ля Диаграмма VIII-20. Давление водяного пара над раствором HjS04. Рисунок VI11-21. Решение kppevnya Tmsperatupi * НГ 04$.
Давление водяного пара над этим раствором может действовать только до тех пор, пока оно ниже парциального давления в выпускаемом газе. 98) при кипячении разбавленного раствора серной кислоты держитесь от него подальше! Вода, и температура кипения поднимается до 337°C 98,3%, когда lhSO начинает «дистиллироваться» (рисунок VIII-21).
Напротив, избыток серного ангидрида выделяется из более концентрированных растворов. Пары серной кислоты, кипящие при 337 ° С, частично диссоциируют при H> 0 и SOj. Подключайтесь снова, когда он остынет. Поскольку серная кислота имеет высокую температуру кипения, » при нагревании можно отделить обезжиренную кислоту от соли/ f (например, HCl от NaCl).
99) как кислота, H2S04 в водном растворе имеет интенсивность, близкую к хлорной по отношению к первой стадии ионизации(HaS04 ^ Z ^ H * — f HSO«), в то время как 2 — я стадия(HSO,^ Tt H * -f-SO^) значительно более выражена, слабо характеризуется значением/ C2. = «Я * 10».Для температурной зависимости этой константы имеются следующие данные: Температура°C……. 5 15 25 35100 / С.» …………. 0.023 0.016 0.011 0.003 вывода. OEOv
В связи с относительно небольшим значением кг. Смесь HSO ’ 4 и SO-ионов, то есть раствор, содержащий сульфатсодержащие гидрогенизаторы, обладает буферным свойством(V§ 5 add.40).Общее описание таких сульфатных буферов можно найти на рис. VIII-22. рН » 0,3.Децинормальный рН 1.2 и Сантинормальный рН = » 2.1. 100) измерение протонной активности (Ан) в очень концентрированном растворе серной кислоты дает удивительные результаты results.
So в случае моногидрата он будет в 10 раз больше молярного раствора. Это говорит о возможности измеримых концентраций и наличии в жидкости при определенных условиях ЭФК wb (H). Разложение некоторых сульфатов при нагревании происходило путем проникновения серной кислоты, которую использовали алхимики, а затем вплоть до середины 18 века (рис. VIU-23).
Исходным материалом был природный минерал. Содержит сульфаты железа. Последний образовался за счет медленного окисления сульфидов во влажном воздухе, например, 4fes + 90 * -f2HrO = 4fe (oh) so»схема. При нагревании эта соль разлагается и образует оксид железа, серную кислоту, безводную серную кислоту:2Fe (OH) SO» — Fe2Oj + H * SO » — f SOj.
Когда дистиллят разбавляли водой, получали серную кислоту требуемой крепости. специальные механизированные печи используются в сернокислотных установках для сжигания fo j пирита («пирит«).Такая печь представляет собой цилиндр, высота которого разделена на несколько соединенных между собой отсеков, и в каждом отсеке FeS2, подлежащий сжиганию, медленно перемешивается с чугунными ходами, посаженными в общий вал.
Свод ветвей и штрихов устроен таким образом. Что FeSj, загруженный сверху, проходит через все секции по порядку. После этого остатки горения («пилит огарн») выгружаются из печи. Воздух проникает внутрь. Поместите его в печь снизу и пропустите все отсеки вверх. Горение пирита протекает по следующей формуле: 4FeSj-f 1 lOj = 2Fe20 | + 8SOa + 790 ккал.
Температура в духовке достигает 800!^»<адрес>». типичный газ поставки сульфата ffoA содержит около 9% SOjTiO%Oa и 80%Nj. Использование обогащенного кислородом воздуха при сжигании пирита увеличивает концентрацию SO2.Введение более обильного сернистого газа в производство серной кислоты резко увеличивает выход серной кислоты.
104) метод псевдоожиженного слоя широко используется при сжигании пирита (и многих других технологически важных процессах).Работа этого способа осуществляется путем продувки силовой струи, подаваемой снизу. Рисунок VII1-22.Характеристика буфера серной кислоты. О. Г. И О. Б. О. Мордог я так * Общий USB ^ PS Рисунок VI11-23. Получают серную кислоту в 16 веке. Воздух проходит через массу хорошо измельченного твердого вещества (или смеси веществ).
Из-за огромной общей реакционной поверхности взвешенных твердых веществ реакция протекает быстро и полностью. Пирит ki показан на рисунке. ВМ1-24.Температура кипящего слоя поддерживается на уровне 900°C. дымовые газы содержат до 14% S02. Природный сульфат кальция может быть использован в качестве сырья для производства серной кислоты.
За счет сильного нагрева в смеси с Коксом протекает эндотермическая реакция: CaSO + C-f 94 ккал = CO-f S02 + CaO. Этот процесс осуществляется в цилиндрической вращающейся печи, которая нагревается путем сжигания угольной пыли. Температура в печи достигает 1500°С. дымовой газ содержит около 8%S02.
При добавлении необходимого количества глины и песка в исходную смесь добавок одновременно получают более 1 тонны цемента на каждую произведенную 1 тонну серной кислоты. 106) ежегодный общий объем вывоза S02, включая отходящие газы металлургических заводов, достигает нескольких миллионов тонн (половина из них-сера).
Эти газы обычно содержат не более 5% SO*. для извлечения из них диоксида серы предварительно охлажденный беспыльный газ пропускают через раствор смеси солей сернистой кислоты, в том числе сульфитов и солей алюминия. Такой раствор хорошо поглощает диоксид серы в холодную погоду и выделяет диоксид серы при нагревании.
Другой способ улавливания диоксида серы из выхлопных газов (в количестве дымовых газов) основан на реакции (МН») £ ое-F S02 + Н20 * * 2nh » hs03.Его баланс перемешивается вправо на холоде, влево при нагревании под вакуумом. При сжигании серосодержащего топлива необходимо удалять очень большой приток диоксида серы в атмосферу. atmosphere. So ежегодные выбросы дымовых газов S02 в Нью-полке составляли около 150 млн. г (1954). Ряса. VI11-25.Схема башенного способа получения серной кислоты.
Принципиальная схема башенного способа получения H2SO приведена ниже. Плиты выложены кислотоупорными керамическими плитами с наружным кожухом из стальной пластины. Внутри, кислотоупорная керамическая насадка не заполнена прочно.
Газ, поступающий из печи пиролитического горения (L), освобождается от пыли электрическим пылеуловителем (5), подается в производственные башни (B и D) и вытекает сверху»нитрозой», то есть сильной серной кислотой; особенностью этого раствора является следующее равновесие. NO-f N02-f-2HsS04 / * = t N203-f 2H2SO, 2S02 (0H)0N0 +Н20 Керчида Воздух Диаграмма VIII-24. схема ки * Миртл * псевдоожиженном слое. jEjr РН ^ зя-я
Таким образом, нитроза содержит оксиды азота и химически связывает (SO2 (0H) 0N0-t. It растворяется легко, в таком виде вам нужно восстановить файл. Окисление SOj — это только последнее. При нагревании восстановленное равновесие перемещается влево и вправо при охлаждении. В производственных башнях, куда поступают горячие газы (а также подается вода), этилаты полностью разлагаются, и почти весь введенный диоксид серы окисляется.
Конечный продукт выбирается из первой башни (B). В абсорбционных колоннах(D и£) оксиды азота задерживаются в процессе образования нитрозы и подаются обратно в производственную колонну. Выхлопные газы (такие как свободный азот) удаляются из верхней части последней абсорбционной колонны (£).Движение газа в системе поддерживается мощным вентилятором.
Азотная кислота вводится в производственные колонны для компенсации некоторых потерь оксидов азота. Схематический чертеж производства серной кислоты контактным методом по фиг. 26.Газ, образующийся в печи (а), проходит через Сухой электрофильтр (в), увлажнительную колонну ©, влажный электрофильтр (г), осушительную колонну (л), контактное устройство (в), содержащее окислительный катализатор, и абсорбционную колонну (г).
Полученный олеум отбирают из нижней части последнего, а выхлопные газы(например, воздушная партия) удаляют из верхней части. В настоящее время большинство контактных установок не работают с платиной, но работают с очень дешевыми ванадиевыми катализаторами (VaOs, Ag3VO и др.).
Активность реакции образования S03 также очень высока (рис. VIII-27).Чаще всего используют V2O с различными добавками (SiO2, KOH и др.). 109) обычно олеум продается с содержанием растворенного S03 не более 25%.То есть она значительно меньше той, которая соответствует пиросульфокислоте (45 мас.%).Последние кристаллы плавятся при температуре 35 ° С и очень гигроскопичны.
Свечение пиросульфата приводит к элиминации$ Oe пиросульфатом. Например, по схеме: Na2S20? = Na2SO < — f-SO3. Также были получены соли фторида и серной кислоты (HS207F) (K, Na, NH»). 110) при взаимодействии SOj и NSS, по-видимому, образуются очень взрывоопасные соединения. Формула[СУ.] [HS207) приписывается PMA.* Если это так, пиросульфат является более мощным, чем перхлорат.
111) Na2S3Oi0 получают действием SO3 и Na2S207.Соответствующая trnseries кислота HtS30″ o «соответствует структурной формуле HO_SO * — O — SQj_O_SO» — OH. At нормальная температура, Na2S3O / 0 более стабилизирована чем пиросульфат, и только на 150°С и выше, SOJ извлекается и перенесен к пиросульфату. Соль ок.
Переходы типа Sr и Ba происходят примерно при 75°C. интересными производными H2SjOio являются красные взрывчатые вещества (СУ2) 25зою (т.75еС), который получается взаимодействием ксзз с избытком soj. По-видимому, производные кислоты H * S «0/3 и H ^ Oc также могут быть present. In сам олеум, равновесие предполагается по общей схеме HjSO» 4-nSOj * * ^ ^ ^ — цОая-ц (N = 1, 2 или 3). Рисунок VI11-27.
Выход SO3 каталитическим контактным методом. 112) при взаимодействии йода и олеума образуется синий раствор. Результаты исследования их свойств свидетельствуют о наличии окислительно-восстановительного равновесия по схеме. I, 4-H7S3Or-f 3S03 ^2Г-f 2HS20; + S02 или 21, 4-H? С20? 4-3СО,^ 4-2HS20-4-S02.Возможно, не исключена возможность равновесия по схеме: Ia4-S03 I2S03 I + 4-SO, I〜.
Интересно, что цвет рассматриваемого раствора йода одинаков. Как придаток с крахмалом (VII§ 3 add.11). 113) вышеуказанные свойства окисления серной кислоты (mp65°C, разложение) очень замечательны, но при нормальной температуре она очень медленно реагирует со многими восстановителями, поэтому окисление практически не происходит.
Характеристические ионы H2S2Oe, что значительно ускорит такой процесс, являются ионы AG, в присутствии которого серной кислоты выше могут окисляться МН»в » НМПО»».Интересно, что Тио сульфаты окисляются им только до тетратонатов (не окисляются до сульфатов). 114)ч * s»в соответствии с уравнением, когда ч * S2Os взаимодействует с концентрированной перекиси водорода, в 4-ю * = 2HjSOs, а mononaderic кислоты, в котором формируется структура соответствует серной кислоте.
В свободном состоянии эта кислота представляет собой бесцветное, гигроскопичное кристаллическое (Мп 47°с, разложить).Мононенасыщенная кислота! Он является еще более сильным окислителем, чем супер-сера, и его взаимодействие со многими органическими веществами (например, бензолом) сопровождается explosion.
It является более стабильным в кислой среде, чем HjSjOs, и менее стабильным в нейтральной и щелочной среде. Вшю и найти. Соль Hjso-это unstable. In в них кислота обычно появляется в виде Ка единичного основания. Это связано с трудностью ионизации водорода группы-UN (/C,«b-10 -«).
116) как видно из вышеизложенного, обе суперкапуляции серы образуются перекисью водорода. Сам HjOj легко доступен из них, и я использую его в technology. To для этого мощный H SO SOэлектрол Электролизуется, и первая образовавшаяся надосадочная кислота быстро разлагается по реакции: hjsjo / + 4-H20 = HjSO » 4-H2SO $.После этого, кислота Деррика Мононы также разлагает медленно.
H2S054-Н} 0 = H3SO44-Нг02.Полученный H»Oa отгоняют из реакционной смеси при пониженном давлении. Конец вышеуказанной реакции является удивительно обратимым; поэтому, когда сильный раствор H H H h h h смешивается с so, мононазерная кислота образуется снова. 116) перекись водорода (IV§ 5 add.12) напротив, оба ядра серы n. она реагирует с подкисленным раствором KMnO и окисляет свободный йод KI Yu при рН = 7,5-8,0.
Взаимодействие с НАО включает высвобождение квенеллолола. Моносульфокислота легко растворима в эфире, а супер серная кислота едва растворима. Раствор Kg ^ gOb в воде при нормальных условиях составляет около 45 г / л. a (Nha) jSjO | — более 750 г / l. It это также BaSjOg, который немного растворим в воде. При нагревании персульфат с удалением кислорода переходит в Нитросульфат.
117) 65% длительное воздействие K S2 S2Og на олеум может быть обусловлено иадтетрасульфатом калия-K * S 0 0H. эта бесцветная соль сочетает в себе структурные характеристики пиросульфата (S-O-S связь) и персульфата (svial) 5-O-O-S). он бурно реагирует с водой, окисляя KI и отбрасывая KMnO.
Потеря активного кислорода происходит при 130°C, а примерно при 250 ° C начинается удаление SO3. 118) в дополнение к серной кислоте сообщалось о перекиси серы. Под действием раскаленного добела разряда на сильно охлажденную смесь SOj с большим избытком кислорода образуется белое кристаллическое вещество, соответствующее формуле»SO» (молекулярная масса определяется понижением температуры замерзания HjSO).
В СВС он плавится, кислород частично удаляется и поступает в маслянистую жидкость в составе SjO; это затвердевает при 0°С с помощью воды, кислород только медленно удаляется,$ 04 разлагается, кроме того, разлагаются как миозиновая кислота, так и перекись водорода.
Она формируется. Окислительные свойства SO (например, 2-валентный марганец преобразуется им в полувалентный), судя по характеру реакции, само перекисное окисление серы не иссякает, а является атомарным кислородом, который выделяется в процессе decomposition. SO в растворе, по-видимому, также получается действие фтора на концентрированную серную кислоту по реакции: Fa + H2SO <= 2HF-f S04.
It следует отметить, что точное соответствие индивидуальных свойств пероксида серы вышеуказанному составу не имеет никакой определенности. 119) известен пероксо-фторид серы: S2of2 (Мп.- 55.Mp.67°C) и SjOjFie(mp.- 95.Мп.49°с). Представляет собой производное H202.Водород связан с радикалами-S02F или-SFe. Первое из этих соединений очень легко диссоциирует по схеме с энергией активации 25 ккал моль: S2 (H2of2) — 22 ккал * * * * 2SO » F.
ядерное расстояние в молекуле 2-го соединения составляет< * (SF)= «= 1.56、»(00)= 1.47 и «(SO)= 1.66 A. 200°C кроме того, 5-членное кольцо, вероятно, будет присутствовать состав S2osfa(mp.- 95.Мп.35°С) персидская производные финансовые инструменты, перечисленных. При воздействии света с длиной волны 365 мкм смесь SOj и F20 образует желто-зеленый FSOjOOF (bp 0°C), стабильный до 50 см3.
Смотрите также:
| Окислительно-восстановительные реакции | Круговорот серы в природе |
| Подгруппа марганца | Катализ |
