Оглавление:



Сероводород
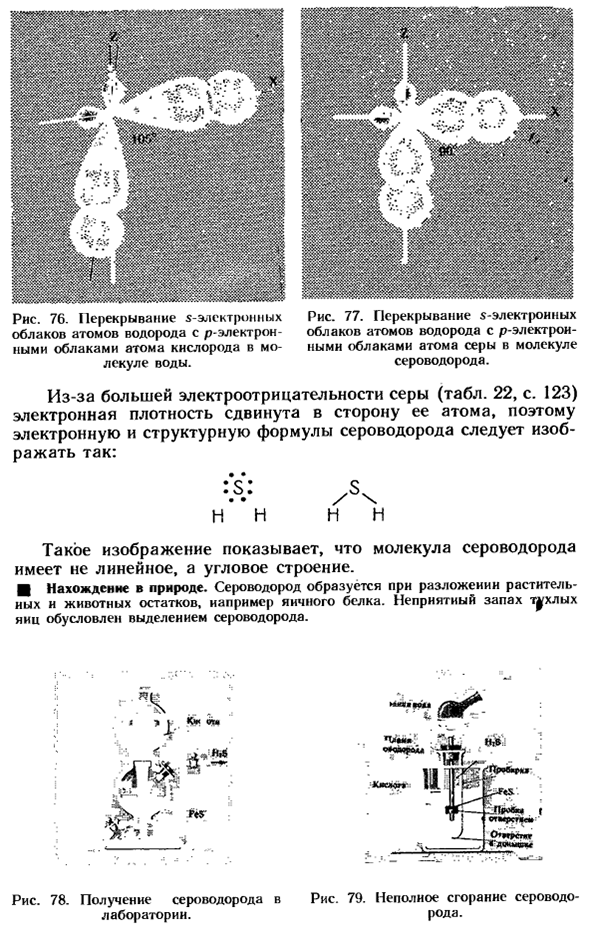
- Сероводород Повторите из главы VII § 2. Структура молекул сероводорода напоминает структуру молекул воды (рис. 76 и 77). она образована наложением S электронных облаков атомов водорода и P электронных облаков атомов серы.
- Поскольку Р-электронные орбитали перпендикулярны друг другу(стр. 115), 5 электронных облаков и Р перекрытие электронного облака происходит под углом около 90°(рис.77). Рисунок 76.Облако S-электронов и облако P-электронов перекрывают атом кислорода атома водорода в молекуле воды. Диаграмма 77.
S-электронное облако и P-электронное облако перекрывают атомы серы атомов водорода в молекулах сероводорода. Людмила Фирмаль
Из-за большой электроотрицательности серы(табл. 22, стр. 123) электронная плотность смещается в сторону атома, поэтому электронная и структурная формула сероводорода должна быть представлена следующим образом: с::•• Н. Н. Н. Такие изображения показывают, что молекулы сероводорода не линейны, а имеют угловую структуру. ■В природе.
Сероводород образуется при разложении растительных и животных остатков, таких как яичный белок. Неприятный запах тухлых яиц вызван выделением сероводорода. Рисунок 78.Получение сероводорода показано на рисунке 79.Неполное сгорание сероводорода в лаборатории. Нравится. И Н Сероводород содержится во многих минеральных источниках.
Они богаты некоторыми источниками, особенно на Кавказе (мацуест^, Пятигорск).Раствор сероводорода (сероводородная вода) обладает кислым свойством, поэтому его иногда называют сероводородной кислотой. Эта кислота очень слабая. Его соли называются сульфидами. Мы получили ваши отзывы. Суспензия получается при действии соляной или серной кислоты на определенные сульфиды (Na, S, K2S, MgS, CaS, 2nS, MnS, FeS). в лаборатории обычно используют сульфид железа (II) и соляную кислоту(рис. 78): FeS + 2HCI H2Sf + FeCI、
Физические характеристики. Сероводород-бесцветный газ, немного тяжелее воздуха и имеет неприятный запах. При 20°C примерно 2,5 объема сероводорода растворяются в 1 объеме воды. Химическое свойство. Химические свойства сероводорода следует отличать от свойств его раствора. Их характеристики приведены в таблице 31.
- Таблица 31 Химическое свойство Раствор сероводорода в воде Бурно реагирует с кислородом (горит):+Г-20 +12 4 4-2 2h2s + 302 +2Н20+ 2S02 при охлаждении пламени происходит неполное сгорание (рис. 79): 11-2 0 41-2 0 2H2S + 0 — * 2H20 + 2SI реакция с хлором продолжается similarly.
In в этих реакциях окисляющий атом (кислород и хлор) восстанавливается путем объединения электронов сероводорода (точнее, серы с окислительной степенью −2), являющегося мощным восстановителем. Он осаждает железо в форме FeS 1 и таким образом разрушает кровь hemoglobin.
It обладает свойствами, общими для большинства кислот(стр. 79). Людмила Фирмаль
В зависимости от условий следующие реакции образуют нормальную соль (сульфид) или кислую соль (гидросульфид).H2S+ 2Na0H—2H20 + Na2S H2S + NaOH H20 + NaHS 2.Растворимый свинцовый солим. В результате образуется черный осадок: Pb (N03) 2 + H2S- * PbSj + 2HN03 9 т. ■Приложение. Природная вода, содержащая сероводород, в основном используется в лечебных целях в виде сероводородных ванн. Сероводород используется в аналитической химии для определения качественного состава веществ.
Его применение основано на том, что соли сероводорода имеют разную растворимость в воде и кислотах, а также окрашены в разные цвета. Ответьте на вопрос, упражнение 6-9 (стр. 172-173).Задача 3 (стр. 174).
Смотрите также:
| Физические свойства серы | Оксид серы (IV) |
| Применение серы | Оксид серы (VI) |
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
