Оглавление:




Смещение химического равновесия. Принцип Ле Шателье
- Смещение химического равновесия. Принцип Ле-трансфер. Химические условия Равновесие зависит от многих факторов, но главным его фактором является температура РА, давление и концентрация реагентов. Измените хотя бы 1 из этих факторов Тор приводит к изменению состояния равновесия.
- Рассмотрим влияние температуры на химическое равновесие. Из сравнения Формула (ви.14)и (VI.11) продолжается К = К2 A2exp [- E «a /(Щ)] = A exp [- (Ea-E’a) / (RI)}. 74, разница в энергии активации положительных и отрицательных реакций, как видно из рисунка Тии будут равны изменению энтальпии в результате взаимодействия:^ — E «a =ДЯ. И затем… Или К = а ехр [- А /(РТ)] \ НК = \ на-А /(РТ). (Ви. Пятнадцать) (Ви. Шестнадцать)
Поэтому изменение температуры влияет на величину константы Этот. Людмила Фирмаль
Формула (VI. 15) аналогична по форме формуле Аррениуса, но вместо этого Здесь константа скорости и энергия активации используют равновесие Критика: изменение энтальпии в результате реакции и константы равновесия. Уравнение, отражающее температурную зависимость константы равновесия (VI. 15) ры, называется уравнение Вант-Гоффа*.Характер постоянного изменения равен следующему Температурная зависимость определяется знаком изменения энтальпии АН. В An> 0 (эндотермический процесс) повышение температуры, константа равновесия Он будет увеличиваться.
В случае <0 (процесс нагрева) температура повышается Это приводит к снижению К. Уравнение (ви.11) и (VI.12), поднять обе прямые и обратные скорости Reaction. In кроме того, константа равновесия равна、 Энтальпия является формулой (VI. 15), поскольку используется в процессе Изобарических условиях. Vant-в уравнении AE, а не V = const (условие равенства) Гофф, д у изменения внутренней энергии.
Активный комплекс Р \ * 1-часовой / Средства / Реакция * л Один / *、 / Источник Лучший Координаты реакции Но… В Активный / с / Мне./ Источник Вещество Сложный \ \ \ * \ \ \ Товары Реакция Координаты реакции Пять Диаграмма 74.Энергетический показатель соотношения энергий Активация прямых и обратных реакций Это зависит от скорости, с которой реакция растет быстрее с температурой. Если скорость прямой реакции сильно зависит от температуры(ее энергия 74 а, прямой процесс, как следует из рисунка), то (более чем обратный случай) Эндотермические и равновесные константы увеличиваются вместе с температурой.
Энергия. Активация обратной реакции, описанной выше(E «a> E’a, рисунок 74, b), затем прямой процесс Константы тепла и равновесия уменьшаются с увеличением температуры. Например Измеряется с постоянной H2 + b ^^ 2HI, где температура равновесной системы повышается Скорость прямой реакции Xj медленнее, чем значение k2(для реакции 2HI — * Hr + b) — таким образом, константа равновесия обратимой реакции в момент нагрева Она будет уменьшаться.
Создайте график с координатами 1nA ’ — \ / T(рисунок 75) и вы получите возможность Количественное определение экспериментальной энтальпии реакции Данные о температурной зависимости константы равновесия[эталонное уравнение (Ви.16)].Отрезок, вырезанный по прямой линии на вертикальной оси, равен 1pL. Первый АР- Коэффициент пропорциональности A можно интерпретировать как постоянную величину Равновесие при бесконечно высоких температурах.
- Изменение концентрации компонентов в равновесных химических системах Смещение температуры постоянного Однако, это、 Этого не будет change. In факт Для систем, состоящих из H2, h и HI、 Где было установлено химическое равновесие Новости, определяемые константами, равны Vethia Вт В К ВТ К ’/г Но… Введение водорода Рисунок 75.Энтальпия реакции определяется по формуле Линейный градиент: (Или йод), а-образуется эндотермический процесс. Ъ-лихорадка Дополнительное количество привет Обработка ku, константа равновесия (T = const) — постоянная value. In это дело、 Новости смещаются в сторону увеличения продукта (HI).
С увеличением концентрации Радиационное равновесие йодистого водорода смещается в сторону увеличения концентрации Исходный материал. Поэтому, изменяя концентрацию ингредиентов、 Сдвиньте баланс в нужном направлении и увеличьте выход продукта реакции、 Степень использования редких реагентов. Это объясняется принципом равновесного смещения Le Shuttle (A884).В соответствии с Этот принцип.
Влияние различных факторов на состояние химического равновесия Людмила Фирмаль
Состояние химического равновесия, процесс протекает、 Уменьшите это exposure. In дело в том, что повышение температуры усиливается Производят продукты эндотермической реакции, в ходе которой Тепло поглощается снаружи. Реакции с выделением тепла、 При охлаждении он течет более полно. Когда увеличить, а также Потому что реакция стимула давления, сопровождающаяся уменьшением объема、 Как этот процесс помогает уменьшить влияние стресса. Добавить Реакционная смесь, в которой один из компонентов находится в равновесии Предотвратите процесс реакции, которую этот компонент потребляет Ши.
Может показать фактическое использование принципа равновесного смещения На примере синтеза аммиака. Эта реакция экзотермична、 Низкий объем: ZN2 + N2 * =±2 NHS(AN <0). Синтез аммиака будет завершен при более низкой температуре (AJ <0).Однако、 При низких температурах процесс достижения равновесия идет очень медленно、 Нагрев необходимо ускорить. Отопление помогает уменьшить Выход аммиака за счет ускорения реакции эндотермической диссоциации NH3.Однако образование аммиака сопровождается уменьшением、
Может компенсировать уменьшение объема, выхода аммиака за счет нагрева Повышенное давление в системе. Поэтому одновременное увеличение Повышение температуры и давления ускоряет процесс достижения равновесия、 Увеличьте выход аммиака(таблица 15). Таблица 15.Зависимость выхода аммиака от температуры и давления. Температура°C 400. Четыреста пятьдесят 500. Пятьсот пятьдесят 600. 0.1 0.405 0.214 0,1216 0,0736 0.0470 Объемное содержание Десять 25.37 16.10 14.87 6.82 4,53 Аммиак Тридцать 48.18. 35.87 25.80 18.23 12.84 (% )
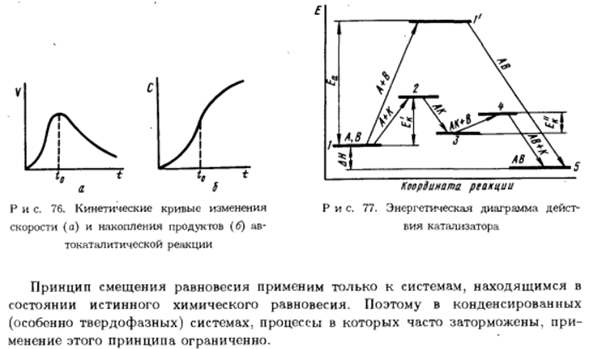
При давлении, МПа Восемьдесят 79.34 62.70 51.05 40.19 30.92 Со стола. 15 показывает, что выход аммиака увеличивается с увеличением температуры при р = const. Однако в T-const、 Смесь газов резко возрастает. ¦- Ноги Рисунок 76.Динамическая кривая изменения Скорость (a) и накопление продукта (b) av- Каталитическая реакция Координаты реакции Диаграмма 77.
Энергетическая фигура действие Кий катализатор Принцип смещения равновесия、 Истинное химическое равновесное состояние. Следовательно, сгущенное Система (особенно твердая фаза), процесс, который часто ингибируется、 Вариации этого принципа ограничены.
Смотрите также:
