Оглавление:






Соляная кислота и ее соли
- Соляная кислота и ее соли Мы получили ваши отзывы. Соляную кислоту получают путем растворения хлоргидрата в воде. В лаборатории можно получить соляную кислоту с помощью устройства, показанного на рисунке 70.
- При проведении этого эксперимента внимательно следите за тем, чтобы конец вентиляционной трубы находился близко к уровню воды, но не погружался в воду. Если это не учитывать, то из-за высокой растворимости хлористого водорода вода вместе с серной кислотой попадает в пробирку, что может привести к взрыву.
В промышленности соляную кислоту получают путем сжигания водорода в хлоре и растворения продукта реакции в воде. water. Людмила Фирмаль
To реализуйте эти процессы, используйте установку. Этот рисунок показан на рисунке 71. Физические характеристики. При растворении хлористого водорода в воде можно получить 1,19% раствор соляной кислоты плотностью 3 г / см3 40%.Однако коммерческая концентрированная соляная кислота содержит около 0,37% массовой доли, или около 37% хлористого водорода.
Плотность такого раствора составляет около 1,19 г / см3.При разбавлении плотность раствора уменьшается(Приложение II, стр. 273). Концентрированная соляная кислота представляет собой бесцветный раствор, который выделяет резкий запах хлористого водорода во влажном воздухе.
Химическое свойство. Соляная кислота имеет много общего Характерные свойства для большинства кислот(с. 79). кроме того, существует несколько специфических свойств(табл.27). Таблица 27.Химические свойства соляной кислоты Вси свойства, общие с другими кислотами HCI с особые свойства 1.Изменение цвета индикатора 2.
Взаимодействие с металлами: 2HCI + Zn — » — ZnCI2 + H2t 3.Взаимодействие с основными и амфотерными оксидами: 2HCI + CaO — * CaC12 + H20 2HCI + ZnO- * ZnCl2 + H20 4.Взаимодействие с основаниями: 2HCI + Cu (OH)2-CuC12 + 2H20 5.Реакция с солью: 2НС1 + cac0s — » — H20 + C02t + Cac121.Реакция с нитратом серебра (нитрат серебра является реагентом соляной кислоты и ее солей); образуется белый осадок, который не растворяется в воде или кислоте: HCI + Agnosos-AgCIJ + HN03 2.
Взаимодействие с окислителями (Mn02, KMp04, KSYu3 и др.): 6HCI + KSYu8 — * KS1 + 3H20 + 3CI2t Взаимодействие соляной кислоты и ее солей с нитратом серебра используется для распознавания ионов хлора. Признание других галогенидов(бромидов, йодидов) показано в таблице 39 (II, стр. 12). Приложение. Перед нанесением покрытия на изделие из этого металла другими металлами (олово, хром, никель) расходуется большое количество соляной кислоты для удаления железа oxide.
In чтобы соляная кислота вступала в реакцию только с оксидами, а не с металлами, добавляют специальные вещества, называемые ингибиторами. Ингибиторы-это вещества, которые замедляют реакцию. Соляная кислота используется для получения различных хлоридов. Используется для производства хлора. Раствор соляной кислоты назначают больным с пониженной кислотностью того же»прошлого сока».
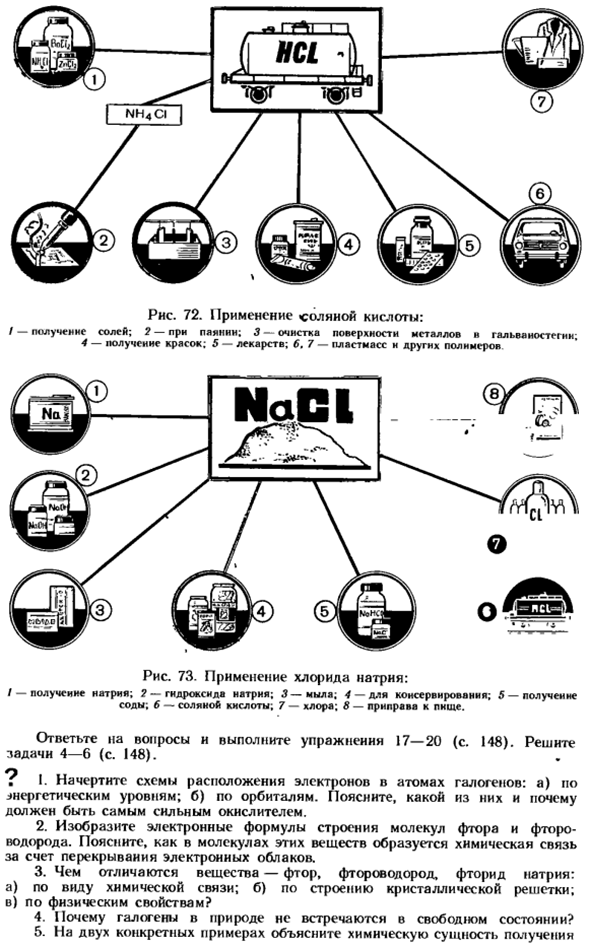
Использование солей соляной кислоты и ее наиболее важного хлорида натрия более четко показано на рисунках 72 и 73. Генетическая связь между хлором и его наиболее важными соединениями показана на схеме 23. Диаграмма 72.»Применение соляной кислоты: / — наличие соли. 2-в том числе пирамин; 3-Очистка поверхности и гальваника металла; 4-прием краски; 5-медицина; 6.7-пластмасса и другие полимеры Диаграмма 73.
Применение хлорида натрия: / — Получение натрия. 2-гидроксид натрия; 3-мыло; 4-для консервирования. 5-Наличие соды. в-соляная кислота; 7-хлор; 8 — пищевая приправа. Ответьте на вопросы и выполните упражнения 17-20(стр. 148).Задача 4-6 (стр. 148). ? I. нарисуйте схему расположения электронов в атоме галогена. а) по уровню энергии. б) вдоль траектории движения. Объясните, какой из них должен быть самым мощным окислителем. 2.
Электронная формула строения молекул фтора и фтор-водорода. Наложение электронных облаков объясняет, как образуются химические связи в молекулах этих веществ. 3.В чем разница между веществами-фтором, фтористым водородом, фторидом натрия: а) в зависимости от типа химической связи. б) строение кристаллической решетки; в) по физическим свойствам? 4.Почему галогены не могут быть найдены в свободном состоянии в природе? 5. 2. химические свойства препарата объясняются на двух конкретных примерах. Состояние галоида свободное.
Каковы галогены, которые легче всего выделить в свободном состоянии, и какие из них? 6.Объясняет изменение физических свойств галогенов в зависимости от изменения относительной атомной массы галогена. 7.Понять структурные особенности кристаллической решетки, объяснить, почему и как отличается температура плавления вещества. Его формула: C12. HCI, NaCI. 8.Как изменяются химические свойства галогенов в ответ на увеличение относительной атомной массы галогенов?
9.Создайте уравнение для химической реакции, которое показано ниже. а)взаимодействие лития и хлора. б) сжигание железного порошка в хлоре. В) горение водорода в хлоре; г)реакция хлора с водой; д) взаимодействие хлора с гидроксидом калияпри высоких температурах(с. 91).Поместите состояние окисления поверх химического символа. Объясните, что будет окислено и что будет восстановлено в этих реакциях.
- 10.Почему Синяя лакмусовая бумажка становится красной со свежеприготовленной хлорированной водой и красной в течение длительного времени с хлорированной водой? 11.Раствор крахмальной пасты добавляют к водному раствору йодида калия. Затем хлор пропускали через этот раствор. Как изменился цвет раствора? В чем причина? (См. 149-страница лаборатории эксперимент.)
12.Создайте уравнение для химической реакции, которая может выполнять следующие преобразования: CI2 — > — CuCl2 — » — Cu (OH)2-> CuO- — CuCl2 — * Cu. 13.Схема 22 (стр. 140) позволяет создать 2 или 3 примера химических уравнений для каждого конкретного случая. 14.Какие химические свойства хлора используются на практике? Напишите уравнение соответствующей реакции.
15.При взаимодействии любого химического вещества, известна его химическая формула, образуется хлористый водород. Людмила Фирмаль
16.Какие галогениды водорода являются самыми сильными, а какие связи-самыми слабыми? 17.Формулы следующих веществ указаны: цинка, меди, алюминия, САО, Ѕіо2, Fe2os, раствор NaOH, от al1 (он)3, ионов Fe2(S04)3, CaCOs, Фе(с бортовым номером 03) 3.Какое из этих веществ вступает в реакцию с соляной кислотой? Создайте уравнение для соответствующей реакции.
18.Подумайте о том, где соляная кислота производится или используется в домашних условиях. 19. Запишите в блокнот резюме ответов о хлоре и соляной кислоте в соответствии с моделью, описанной на стр. 43. 20.Составьте уравнение реакции по схеме 23 (стр. 146). F 1.Сколько составляет количество избыточного хлора, поступающего в организм в нормальных условиях, которое выделяется при взаимодействии оксида марганца (IV) Mn02 с 17,4 г соляной кислоты?
2.In герметичный контейнер, 8 л хлора был смешан с 12 л водорода, в результате чего смесь взорвалась. Сколько было получено хлористого водорода?•Какой газ и сколько осталось в избытке? 3.100 мл газовой смеси для синтеза хлористого водорода пропускали через раствор калия iodide. As в результате было выделено 0,508 г йода. Был ли состав газовой смеси в процентах (по объему)?
4. Рассчитайте, достаточно ли 140 мл раствора соляной кислоты (Р> 1,1 г / см3) для полного взаимодействия с 13 г цинка. 5.Избыток концентрированной серной кислоты подвергали взаимодействию с 58,5 г хлорида натрия и полученный хлористый водород растворяли в 146 г воды. Определите массовую долю и процентное содержание хлористого водорода в полученном растворе. 6.Около 400 объемов хлористого водорода растворяют в 1 объеме воды при комнатной температуре.
Рассчитайте массовую долю и процентное содержание хлористого водорода в полученном растворе. Лабораторные опыты Хлорное отбеливание красителя. В пробирку наливают 4-5 мл воды и добавляют 1-2 капли раствора фуксина или фиолетовых чернил. Добавьте небольшое количество хлорированной воды в красящий раствор. Раствор обесцвечивается. Задача. Почему решение было запятнано?
Напишите уравнение соответствующей реакции. Если вы подвергаетесь воздействию хлора, подумайте, будет ли высохшая ткань пятна исчезать. Растворение йода в воде и органических растворителях. В 1 пробирку 2-3 мл воды, в другую 1 пробирку такое же количество керосина, положить спирт в 3-й тест tube. In все пробирки опустите на несколько кристаллов узла и хорошо встряхните.
Йод лучше всего растворяется в спирте, а в худшем случае-в воде. Сублимация йода. Когда несколько кристаллов узла помещены в пробирку и нагреты, появляется пурпурная пара. На стенках трубки снова образуются узловые кристаллы. Задача. В чем разница между явлениями, возникающими при нагревании, такими как хлопья льда и кристаллы йода в пробирке? Что такое сублимация? Дать определение.
Действие раствора йода на крахмал. В пробирку налить 2-3 мл воды, добавить немного крахмала, встряхнуть, вскипятить 2-3 мл воды и вылить ее содержимое во 2-ю пробирку. Полученный раствор крахмала разливают в 2 пробирки и refrigerated. In в 1 из них добавляют несколько капель калия, а в другой 1-добавляют раствор узла в alcohol. In в первой пробирке изменений не наблюдается, во второй пробирке появляется синее пятно. Задача. Как вы можете доказать наличие свободного йода?
Как обнаружить крахмал в таких продуктах, как белый хлеб? Последовательность замещения галогенов друг от друга из соли. В 1 пробирку наливают раствор бромида калия или натрия 3-4 мл а во 2 и 3 такое же количество калия или натрия iodide. In в первую и 2-ю пробирки добавляют 1-2 мл хлорированной воды, а в 3〜ю-такое же количество бромной воды. Желтый цвет наблюдается в первой трубке, коричневый-во 2-й и 3-й трубках. Задача. На что указывает изменение цвета пробирки?
Напишите соответствующее уравнение химической реакции. Основываясь на эксперименте, мы опишем порядок, в котором галогены перемещаются из одного соединения в другое. Как я могу отличить бромид и йодид? Практика 3 Возьмите соляную кислоту и поэкспериментируйте с ней. I. получить соляную кислоту. Рисунок 70(стр. 145) соберите устройство, как показано на рисунке. Налейте 2-3 г хлорида натрия в пробирку и добавьте концентрированную серную кислоту (2: 1), чтобы смочить все соли.
Закройте трубку газоотводной трубкой. Край газоотводной трубки опускают на другую трубку так, чтобы она находилась примерно в 0,5-1 см от поверхности воды. Затем тщательно нагрейте смесь в первой пробирке в течение 5-6 минут(не позволяйте кислоте переходить во вторую пробирку с водой!). Задача.
Между концентрированной серной кислотой и хлоридом натрия в нормальных условиях пишут уравнения химических реакций, протекающих при сильном нагревании. В чем причина появления 2-ой трубки, в которую попадает тонкая струйка? 2.Химические свойства соляной кислоты. Растворите хлористый водород в воде и равномерно влейте полученную соляную кислоту в тест 6 tubes.
In первая пробирка, бросьте синюю лакмусовую бумажку. Во 2-ю пробирку кладут цинковую или магниевую стружку, а в 3-ю-медную стружку. Поместите небольшое количество оксида меди (II) в 4-ю трубку и нагрейте раствор. В 5-ю пробирку поместите свежеприготовленную гранулу оксида меди (II) нидолия и небольшой дроссель или другой карбонат в 6-ю пробирку. Задача. I. вступает ли соляная кислота в реакцию со всеми металлами?
Создайте уравнения реакций, протекающих между соляной кислотой и определенными металлами. 2. Почему синий раствор образовался в 4-й и 5-й трубках, а газ вышел в 6-й трубке? Состав уравнения соответствующей реакции. 3.Распознавание соляной кислоты и ее солей. Поместите 1-2 мл разбавленной соляной кислоты в 1 пробирку, 2 в такое же количество раствора хлорида натрия и 3 в раствор хлорида кальция.
Добавьте несколько капель раствора нитрата серебра (или нитрата свинца (II)) в каждую пробирку Свинец (№ 2).Проверьте, не растворен ли осадок в концентрированной азотной кислоте. Задача. Напишите уравнение соответствующей реакции и подумайте, как ее можно отличить. а) соляная и другие кислоты. 6) хлорид из других солей; в) раствор хлорида из соляной кислоты. Почему вместо раствора нитрата серебра (I) можно использовать раствор нитрата свинца (II)?
Практика 4 Решение экспериментальных задач. 1. Получить хлорид цинка можно 4 различными способами. 2. Получают хлорид меди (II) 3 различными способами. 3.Определите мешки, содержащие хлорид натрия, бромид Найфх, йод натрия и карбонат натрия. 4.Раствор соляной кислоты. Проверьте его качественный состав экспериментально.
5.Даются твердый хлорид магния и хлорид алюминия. Идентифицируйте эти вещества с помощью характерных реакций. 6. Раствор подают в 4 пробирки. соляная кислота. б)хлорид натрия; в)гидроксид натрия; г) нитрат серебра(I).Определите вещество, используя характерные реакции. 7. В Трне используют смесь карбоната натрия и хлорида. Затем отделите хлорид натрия. 8.Упражнение почти следующее ia: CuC03-«-CuCl2- » — CutOH ^ CuO — ^ CuClj — ^ Aga.
Смотрите также:
| Применение галогенов | Положение кислорода и серы в периодической системе элементов, строение их атомов |
| Хлороводород | Строение простых веществ. Аллотропия |
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
