Оглавление:



Свойства реальных газов.
- Свойства реального газа 。Реальный газ отличается от идеального тем, что молекулы этих газов имеют конечный внутренний объем и связаны между собой силами взаимодействия, которые являются электромагнитными и квантовыми свойствами. Эти силы существуют между каждой молекулой!При любых условиях она уменьшается по мере увеличения расстояния между молекулами.
Когда молекула приближается на небольшое расстояние, притяжение резко уменьшается, превращаясь в силу отталкивания, которая имеет очень большую величину. их объема законы идеальных газов точно не применимы к реальным газам ни при каких обстоятельствах. При фактическом расчете различных свойств
Из-за наличия сил взаимодействия между молекулами и конечности Людмила Фирмаль
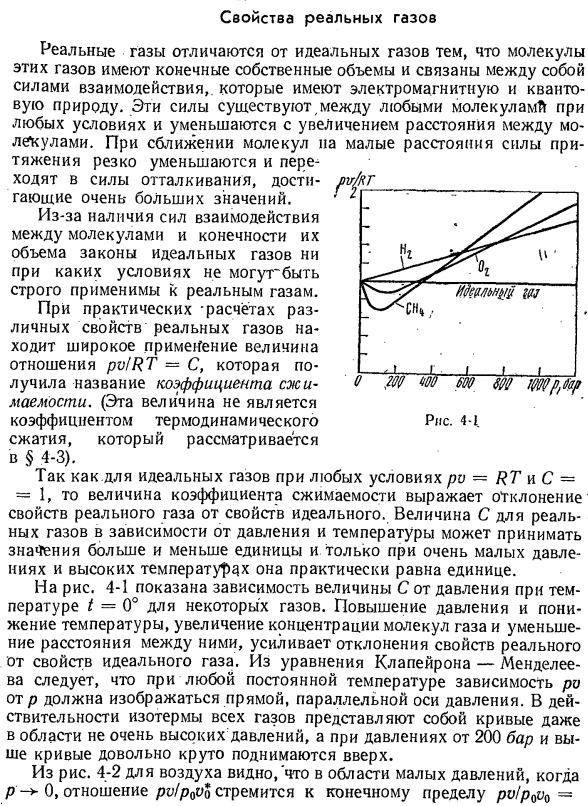
реального газа широко используется отношение pv / RT = C, называемое коэффициентом сжатия. (Это значение не является термодинамическим коэффициентом-рис. 4-1 Сжатие, это объясняется в§ 4-3). для идеального газа при любых условиях ri-RT и C-= 1 коэффициент сжатия представляет собой отклонение природы реального газа от природы идеального газа. Значение с фактического
газа может принимать значение больше 1 и значение меньше 1, в зависимости от давления и температуры, и только при очень низком давлении и высокой температуре фактически будет равно 1. На рис. 4-1 показана зависимость величины С от давления при температуре t = 0°для некоторых gases. An увеличение давления и снижение температуры, увеличение концентрации молекул газа
- и уменьшение расстояния между ними увеличивают отклонение реальных свойств от характеристик идеального газа. Из Формулы Клапейрона-Менделеева видно, что если температура постоянна, то зависимость ri от p должна быть выражена прямой линией, параллельной оси давления. Дело в том, что изотерма всех газов представляет собой кривую даже в тех областях, где она не столь высока, а при давлении более 200 бар кривая поднимается очень резко.
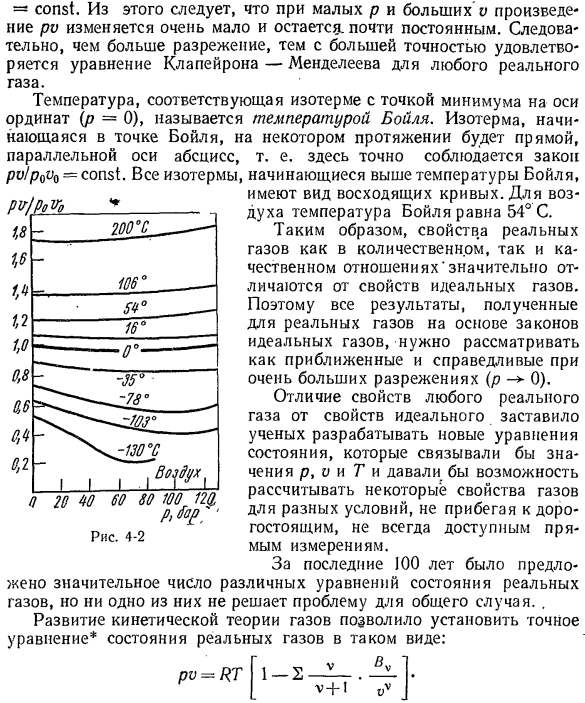
В случае воздуха из рисунка видно 4-2. ’В области низкого давления, если p-> 0, отношение pv / p0vo стремится к конечному ограничению pv / p0v0 = — const. и остается почти неизменным constant. As в результате, чем больше степень разрежения, тем точнее уравнения Клапейрона-Менделеева удовлетворяются
Из этого следует, что для малых р и больших о произведение Р почти не изменяется Людмила Фирмаль
реальным газом. Минимальная точка на вертикальной оси(? Температура, соответствующая изотермам (=0), называется температурой кипения. Изотерма, начинающаяся от точки кипения, представляет собой линию, в некоторой степени параллельную оси абсцисс. То есть здесь строго соблюдается закон pv)p0v0 = const. Вся изотерма начинается при температуре кипения или выше、 Это похоже на восходящую кривую. Для воздуха температура кипения
составляет 54°C. Таким образом, свойства реального газа существенно отличаются, как количественно, так и качественно, от характеристик идеального газа. Поэтому все результаты, полученные для реального газа на основе закона идеального газа, должны считаться приближенными и справедливыми для очень большой редкости (P0). Из-за разницы в свойствах фактического газа
и характеристиках идеального газа ученые были вынуждены разработать новое уравнение состояния, связывающее значения p, v и T, позволяющее вычислять характеристики газов в различных условиях, не прибегая к прямым измерениям, которые являются дорогостоящими и не всегда доступными. За последние 100 лет было предложено довольно много различных уравнений состояния реального газа, но ни одно из них не может решить проблему в общем
случае. 。 Развитие кинетической теории газов позволило установить в этой форме точное состояние реального газа. Сто шесть 1,6 У 1,0 0.8 0.6 0.1 sr 16 ′ Рисунок 4-2 — Подкопать. vbq \ \ J_I 60, да. Примерно от 20 до 40. Уравнение 5 Один « pv = RT в + л В этом уравнении коэффициент B \ мощности правой части уравнения, называемый вириальным коэффициентом, выражается потенциальной энергией
взаимодействия молекулы данного газа с температурой 7 \ a и = 2, 3, 4,… N-это реальный фактор. Однако обычно полученные уравнения не могут быть использованы для прямого расчета реального газа. В отдельных конкретных случаях закон изменения потенциальной энергии взаимодействия между 2 молекулами известен
по расстоянию между молекулами (так называемая потенциальная кривая), и если имеется определенное количество экспериментальных данных, то можно получить формулу для расчета реального газа 1 или энной с достаточно широким диапазоном параметров. Поскольку расчет вириального коэффициента является
сложным, он ограничивается вычислением первых 2 коэффициентов. Форма вычисляемого выражения ^равна: Где A и B-первый и второй вириальные коэффициенты. Особенности только температуры. В настоящее время уравнения такого рода широко используются при расчете свойств многих реальных газов. 4 x самым простым и наиболее качественно правильным отражением поведения реального газа является Ван дер Ваальс equation. It берется как частный случай из общего уравнения состояния Майера-вбоголюбова. Игнорируйте все термины, которые содержат 2 или более раз 1 / y в правой части.
Смотрите также:
Решение задач по термодинамике
| Основные свойства газовых смесей. | Уравнение состояния Ван-дер-Ваальса. |
| Газовая постоянная смеси газов. | Анализ уравнения Ван-дер-Ваальса. |
