Оглавление:








Типы связей
- Тип ссылки Связь атома с молекулой газообразного, жидкого или твердого вещества, а также с твердым телом, в котором атом или ион имеет атомную, металлическую или ионную структуру, является химической реакцией. Связывание молекул с веществами в газообразном, жидком или твердом состоянии осуществляется под действием межмолекулярных связей, которые часто называют ван-дер-ваальсовыми силами. Свойства химических и межмолекулярных связей являются однородными и электрическими. Существует несколько типов химических связей, наиболее важными из которых являются ковалентные и ионные.
Ковалентные связи возникают в результате парной социализации валентных электронов, то есть образования общей пары (или нескольких пар) электронов, ранее принадлежавших отдельным атомам. Когда образуется общая пара электронов, из каждого связывающего атома вводится один валентный электрон. Например, молекулы хлора имеют валентные пары, образующие ковалентные связи, а молекулы азота-три пары: Доля е-против Таким образом, ковалентные связи единичны, например, в С12, например, в N2 могут быть кратными(двойными, тройными). Образование электронных пар сопровождается перераспределением электронной плотности и уменьшением энергии системы. Электронное облако «втягивается» в пространство между ядрами соседних атомов, что приводит к увеличению плотности в межъядерном пространстве(рис. 1.2). Повышенная плотность электронных облаков, образующихся в межъядерном пространстве, по-видимому,
притягивает ядра друг к другу и пытается сделать их как можно ближе. Людмила Фирмаль
Поскольку считается, что энергия связи, возникающая в результате согласования пар электронов, образовалась в результате обмена электронами между соседними атомами, энергия обмена фактически является статическим электричеством. На рис. 1.2 представлена принципиальная схема строения атома и молекулы водорода: квантово-механическая модель электронной структуры изолированного атома водорода; то же, что и молекула b-водорода 14. взаимодействие энергообмен между ядром и электронной оболочкой повышенной плотности, в течение которого она образовалась. Обменное взаимодействие имеет квантовую природу, и рассмотрение его с точки зрения классической механики весьма затруднительно. Если молекула состоит из атомов одних и тех же химических элементов (C12, N2, H2 и др.).
Тогда электронная пара (одна или несколько) принадлежит этим атомам в равной степени. В этом случае ковалентная связь неполярна или нейтральна, и образующиеся молекулы также неполярны. В неполярных молекулах центры положительных и отрицательных зарядов совпадают (/=0), поэтому электрический дипольный момент C, КЛ * м, равен нулю: Р=<?Z, (1.1)где q-абсолютная величина заряда, КЛ; / — расстояние между центрами положительных и отрицательных зарядов, м. Дипольный момент часто измеряется в дебае (D); 1D==3,33 м до 10-30CL. Диэлектрический материал, образованный неполярными молекулами, является неполярным. Схематическая структура над молекулами Cl2, N2 и H2 была примером неполярного вещества, образование которого включало неполярную ковалентную связь. Если молекула состоит из атомов различных химических элементов, то электронная пара смещается в сторону атома с большей электроотрицательностью(ЭО).
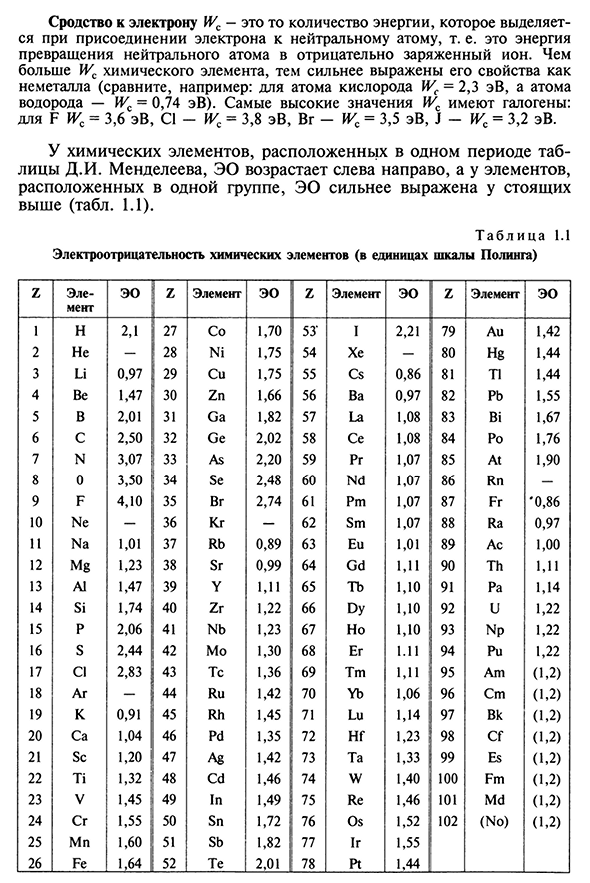
- Измерение EO может быть арифметической суммой энергии ионизации и электронного сродства EO=Wn+(1.2) Wc и должно приниматься в той же единице. Энергия ионизации Ly — это количество энергии, которое необходимо затратить, чтобы преобразовать нейтральный атом в положительно заряженный ион. D. I. In каждый период таблицы Менделеева, химический элемент, с которого начинается период, то есть щелочной металл, имеет наименьшее значение RGI. Например, литий ЗП=5.39 эВ, на-=5.14 эВ, к-жи=4.34 ЭВ и т. д. Химический элемент, заканчивающий период, то есть инертный газ, имеет максимальное значение WK. Например, если н=24.58 зарегился, потом нэ-РГИ=21.56 эВ, АГ-=15.76 эВ. Таким образом, чем больше электронов во внешней оболочке атома, тем прочнее связь с ядром, как правило, тем сложнее превращение атома в положительный ион.
Ионизация атомов (молекул) предпочтительнее быть однократной, так как энергия ионизации возрастает с каждой последующей потерей электронов, а не многократной, особенно электронов (например, в случае аргона AG энергия ионизации 1-го электрона с третьего электронного уровня составляет 15,76 62,62 ЭВ, 2-RGI=ev, 3-EV, 40,9 эВ, 4,79-W=»). например, 5-й-жи=75,0 ЭВ, 6-й — 1г=91,3 ЭВ, 7—й-последний из третьего уровня-почти в три раза длиннее, чем для восьмого электрона. 15 сродство к электронам определяется количеством энергии, которое выделяется при присоединении электрона к нейтральному атому,
то есть чем больше величина энергии химического элемента, преобразующего нейтральный атом в отрицательно заряженный ио Людмила Фирмаль
н, тем более выражены его свойства как неметалла (например, атом кислорода Wc=2,3 эВ, атом-Wc=0,4 эВ, водород eV). Наибольшие значения галогенные с: F ЗК=3.6 эВ, КЛ-ФКЦ=3.8 эВ, ВГ-ЛНР=3.5 эВ, Дж-ЛНР=3.2 эВ. В химических элементах, расположенных в одном периоде периодической таблицы, ЭО увеличивается слева направо, а в элементах, расположенных в одной группе, ЭО становится более выраженным В результате смещения электронной пары в сторону атома с большим ЭО молекула поляризуется: центры ее положительных и отрицательных зарядов, на определенное расстояние / ковалентные связи пары друг с другом становятся полярными, а сама молекула становится полярной или дипольной. Результирующий вектор TS (дипольный момент, вдоль оси диполя, образуется диполем от отрицательного заряда к отрицательному заряду от положительного заряда к отрицательному заряду электрического поля E (BECU 1.3).
Материал состоит из дипольных молекулполярности. Например, молекулы воды полярны, потому что электронная пара между атомом кислорода и двумя атомами водорода смещена атомом кислорода, так как больше EO(рисунок 1.4). При наличии полярной ковалентной связи, если дипольные моменты этих связей компенсируют друг друга, могут образовываться и неполярные молекулы. Например, полиэтилен является неполярным материалом, но он содержит полярную связь между атомами углерода и водорода вместе с неполярной ковалентной связью (между атомами углерода) (табл. 1.2). Однако последний дипольный момент одинаково противоположен, и поэтому компенсирует друг друга. Стрелки здесь и ниже (для ПВХ, ПТФЭ и ПТФЭ) показывают вектор дипольного момента полярной ковалентной связи.
Молекулярная структура подобная полиэтилену имеет масло масла изолируя, парафин и много другого алифатического- ньютон Один. ньютон Один. ньютон Один. ньютон Один. й н н н н Один. — Позже. — Один. Один. — Позже. — Один. Один. — Позже. — Один. Один. — Позже.. Один. Или*S:: S: S: S: S • Один. ньютон Один. ньютон Один. ньютон Один. ньютон Огромные углеводороды, поэтому они тоже неполярные вещества. Главным отличием в структуре является малый размер молекулы. 1.2 дипольный момент химических связей и групп в органических соединениях Химические связи или группы А D-это химическая связь или группа C, D химические связи или группы C, D S-S0S-S1 1.55 S=около 2.70 С=С0 () С-Н0, 4 C=C0C-в g2. 04-С Н3 0,4 С-Ф1. 83C-ч0. 61-О Н1. Пятьдесят восемь С-С1 2,05 Н-Н-Н -, 93-nн 2 1,67 жировые соединения c-0 1,12-nо2 3,96
Для поливинилхлорида (ПВХ), с одной стороны, дипольный момент полярной ковалентной связи между атомом углерода и атомом хлора, а с другой стороны дипольный момент атома углерода и атома водорода 1.2);: Н н н н н ф ф ф ф ф ч Ф ч ф ф Политетрафторэтилен(ПТФЭ)) — Неполярные диэлектрики с-с-с-С.. Или * C: C. H1clf C: C • ч я я я F1F1 Один. ньютон F1 Один. Cl F и н ф I Cl F F]1F1 И: с: С: C — •C: C — * C: C • Ф т ф ф ф ф т ф ф ф ф ф д т Политрифторэтилен (PTFE) — Слабополярные диэлектрики Степень полярности молекул и веществ обычно зависит от следующего: 1) ЭО химического элемента, атомы которого замещены атомами водорода в молекуле углеводорода;2)образованного полярного элемента.) 18 образуется полярная связь, полярная связь в другой даже. Например, молекула бензола C6H6 имеет шестиугольную форму, ее дипольный момент равен нулю. И=о
Когда один атом водорода заменяется атомом одного атома хлора в молекуле бензола, возникает дипольный момент, и молекула становится полярной. При замещении двух атомов водорода атомами хлора, в зависимости от их расположения в молекуле бензола, возникает дипольный момент различной величины: наибольший—в ортопозиции, наименьший-в металле. Ионные связи возникают между атомами с очень большими различиями ЭО. В этом случае электронная пара смещается в сторону атома с большим EO, который фактически заряжен отрицательным зарядом, в то время как атом с меньшим EO является положительным.
Таким образом, ионные связи образуются в результате перехода электронов от одного атома к другому-с большим ЭО, но существуют разные заряженные ионы, например, в статическом NaCl атомы С1 имеют больший ЭО относительно атома Na(см. таблицу). 1.1), следовательно, электроны атома Na переходят к атому С1, при этом первый приобретает положительный заряд, второй—отрицательный: Na+Cl=Na+Cl-из вышесказанного можно сделать вывод, что неполярный 1.3). Неполярные, полярные и ионные молекулы непрерывно переходят для усиления поляризации————————————— ► Т а б л и Ц А1. Три Неполярные молекулы Полярные молекулярные ионные молекулы Н2, СН4, СF4 совместно и HJ, H2S и NH3H2O Asf3b2okj ВАО
натра с=~0 0,11 0,38 0,93 1,46 1,84 2,6 3,5 6,8 7,96 10, Д 19 из таблицы видно, что граница между полярными ковалентными и ионными связями является чисто условной. Из-за однородной природы химических связей нет принципиальных различий в полярности ковалентных связей и механизме образования ионных связей. Эти типы связей не встречаются в чистом виде, они отличаются только степенью поляризации, и поэтому связи между атомами больших различных элементов дипольного момента / 1 образующихся молекул часто являются ионными ковалентными связями. Наиболее ярким представителем соединений с ионными связями являются галогениды щелочных металлов, но их химические связи не являются полностью ионными (до 93-94%).
Смотрите также:
| Классификация кристаллических структур | Классификация материалов, используемых в электро- и радиотехнике |
| Дефекты кристаллической решетки | Строение материалов |
