Оглавление:






Классификация кристаллических структур
- Классификация кристаллических структур Основными типами кристаллических структур являются атомы, металлы, ионы и молекулярные решетки. Атомные структуры-это простые полупроводники (Ge, Si, Se и др.).), Который содержит атомы узла решетки. Химическая связь между атомами является ковалентной связью, она имеет ярко выраженную ориентацию, в результате чего атомы образуют определенную конфигурацию единичной решетки, а также определенное расстояние друг от друга.
В атомных кристаллах невозможно выделить какую-либо группу атомов и считать ее молекулой. В этом случае весь Монокристалл можно рассматривать как одну макромолекулу. Металлическая конструкция имеет металлические проводники и ферромагнетики, а также металлические компоненты. Положительно заряженные ионы располагаются в узлах кристаллической решетки металла, и некоторые из валентных электронов, отколовшихся от атома, становятся свободными. Свободные электроны социализируются (коллокируются) и взаимодействуют с
положительными ионами металлов, образуя электронный газ, который связывает их с твердой системой. Людмила Фирмаль
Химическая связь в металле обусловлена одновременным взаимодействием притягивающей кулоновской силы между собранными электронами и положительными ионами, расположенными в узлах кристаллической решетки. Эта химическая связь называется металлической связью. Под действием металлической связи положительные ионы размещаются в металле на равновесном расстоянии, равном друг другу, соответствующем минимальному энергетическому потенциалу системы, образующей кристаллическую решетку. Ионная структура имеет неорганические Диэлектрики и неорганические полупроводники (оксиды и соединения металлов). Положительно и отрицательно заряженные ионы чередуются в узлах решетки ионных кристаллов.
Ионы расположены таким образом, что кулоновское притяжение между ионами противоположных знаков равно силе отталкивания их электронных оболочек. 20 при нормальных температурах ионная проводимость кристалла пренебрежимо мала, поскольку ионы относительно прочно удерживаются в узлах решетки. Если атомы химического элемента теряют электроны и превращаются в положительные ионы, то их величина значительно уменьшается. Чем больше электронов теряет атом, тем меньше радиус образующихся ионов. Например, радиус атома хрома SG равен 1.25 a(a-Å равен 10-10m), Иона SG+2-0. 84 А, СГ+3-0. 69 А. СГ+4-0. 56 А. напротив, размер атома значительно увеличивается при получении электронов.
- Например, атомы Na и C1 имеют радиус 1,86 и 0,99 а соответственно, положительные ионы Na+и отрицательные ионы SG-0,95 и 1,81 а соответственно. 1.5 атомы и ионы химического элемента рисуются в виде окружностей, а величина радиуса, определенная рентгеновским методом, приводится ниже окружности А. Поскольку катионы (катионы) обычно меньше анионов (анионов), то при росте ионного кристалла катионы обычно образуются в результате плотной упаковки более крупных частиц—анионов, а кристаллическая структура формируется плотной решеточной упаковкой ионов. Например, NaCl(рис. 1.6, а) радиус ионов CL почти в два раза больше радиуса ионов Na+, поэтому Ионы Na+занимают объем, который остается после плотного заполнения кристаллов ионами c1_.
Диэлектрические материалы, такие как Кристалл (SiO2), Корунд (a-A12O3), рутил (TiO2), слюда, радиокерамика и др. Обладают плотной упаковкой решетки ионами ионы, имеющие размер: О2—1.40 а, Си4±-0.41 в, А13±0.50 а турнира TI4±0.68 а, к±1.33 а(рис. 1.5). Размер Иона SG (1.81 A) очень близок к размеру Иона Cs+(1.69 A), поэтому Кристалл CSCL (рис. 1.6, Б) Ионы Cs+могут быть размещены внутри куба, образованного ионами SG, последние должны отойти. Ионы в Подрешетке Cs+также должны отодвинуться, чтобы ионы SG поместились внутри образованных ими кубов. В этом случае образуется структура с рыхлым решеточным заполнением ионов. Неорганическое стекло, мрамор (CaCO3), асбест (3MgO•2SiO2), муллит (ZA12O3•2SiO2)-детали электрокерамики,
минерал циркон (ZrSiO4)-имеет рыхлую сетчатую упаковку в огнеупорной керамике. Людмила Фирмаль
Следовательно, чем больше разница в размерах катиона и аниона, образующих ионную кристаллическую структуру, тем плотнее заполнение решетки. И наоборот, если размеры катиона и аниона очень близки, то образуется структура с рыхлой сеткой заполнения. Свободная упаковка решетки также имеет твердое тело в аморфном государстве. В ионных кристаллах невозможно выделить какую-либо группу ионов и рассматривать их как молекулы. Фактически, монокристаллы можно считать одной гигантской молекулой. При растворении (например, в воде) или плавлении такие кристаллы распадаются на свободные ионы, становятся проводниками второго рода, а при испарении превращаются в молекулы и остаются в диэлектрике.
В ионном кристалле, чем выше сила взаимодействия между положительными и отрицательными ионами, тем больше валентность и тем меньше сумма радиусов. И чем больше сила взаимодействия между ионами, тем ниже твердость кристалла, температура плавления и его растворимость. Молекулярная структура органических диэлектриков (включая полимеры) и органических полупроводников. В отличие от вышеперечисленных кристаллических структур, узлы решетки имеют мелкие частицы (атомы или ионы), которые связаны между собой химическими связями, а молекулярные кристаллы, прежде всего, большие размеры частиц-молекул, оказывают существенное влияние на плотность их упаковки в твердые тела.: К (1.3) Где K-коэффициент упаковки, N-количество молекул в элементарной ячейке, IO-объем молекулы, V-объем элементарной ячейки.
Значение k находится в диапазоне 0.6-0.8. Его минимальное значение-0,595. Ниже этого значения, образование кристаллов невозможно. Межмолекулярная сила (Ван-дер-Ваальсова сила) обусловлена координированным движением электронов в атомах соседних молекул. Энергия этого типа связи пропорциональна шестой кратности расстояния между молекулами. Таким образом, на больших расстояниях между молекулами эти силы ничтожны. Например, в газах нормального давления и температуры они являются 23º не существует. Межмолекулярные силы состоят из трех различных типов взаимодействий: направленного (эффект Киизома), индукционного (эффект Дебая) и дисперсионного (эффект Лондона). Ориентационное взаимодействие происходит в системе, состоящей из полярных молекул.
Его сущность заключается в специфической ориентации дипольных молекул относительно друг друга под действием электростатического притяжения различных заряженных электродов соседних дипольных молекул. В результате дипольные молекулы располагаются в определенном порядке, соответствующем минимальной потенциальной энергии системы. Индуктивное взаимодействие-это взаимодействие индуцированного диполя. Это происходит, когда полярные и неполярные молекулы взаимодействуют друг с другом. Молекулы с разной полярностью ориентируются друг на друга и вызывают ориентационное взаимодействие. Кроме того, они деформируются в результате близкого расположения различных заряженных электродов.
Деформация молекул индуцирует дополнительный дипольный момент, так называемую индуктивную силу, участвующую в образовании межмолекулярных сил. В случае взаимодействия полярных и неполярных молекул в последней возникает индуцированный диполь, который взаимодействует с диполем полярной молекулы. Как показал Лондон, дисперсионная сила действует на материалы, образованные из неполярных молекул. Благодаря пульсирующему движению электронного облака в атоме молекулы существует дипольный момент (между электроном и Протоном), индуцирующий диполь в атоме соседней молекулы, что связано с возникновением в определенный момент в протонной системе мгновенного дипольного момента, равного произведению заряда электрона на его орбитальный радиус.
Существует распределенное взаимодействие между этими электрическими диполями. На самом деле, все три типа взаимодействий проявляются в некоторой степени всегда между молекулами: ориентация, индукция и дисперсия. При этом одно из них имеет основное значение, определяющее структуру и характеристики материала. Полная энергия притяжения между молекулами представляет собой сумму энергий этих трех типов взаимодействий. В отличие от кулоновского взаимодействия, когда противоположные заряды притягиваются, а одинаковые отталкиваются друг от друга, межмолекулярные силы проявляются только в Притяжении.
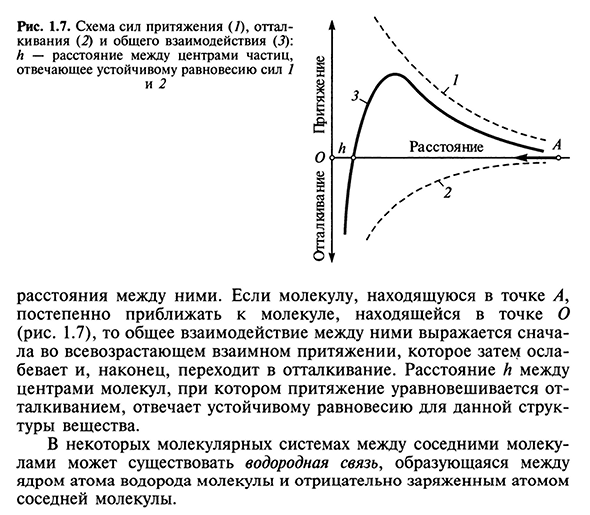
Однако при большой конвергенции любые частицы начинают отталкиваться от своих внешних электронных оболочек. Результирующая сила отталкивания очень велика при непосредственном контакте с частицами, но становится значительно слабее по мере увеличения частиц 24 часа 1.7 схема притяжения (7), отталкивания (2) и общего взаимодействия (5): расстояние между центрами частиц, соответствующее устойчивому равновесию Н-сил 7 и 2
Смотрите также:
| Дефекты кристаллической решетки | Строение материалов |
| Три физических состояния полимеров | Типы связей |
