Оглавление:








Валентность
- валентность Свойства взаимосвязанных атомов, образующих моль Кулу описывается с использованием концепции валентности. уже Дома удельная валентность Единство валентных атомов должно быть насыщено друг другом, То есть каждая валентная связь атома Ленточное соединение другого атома.
- Например, молекула метана СН 4 Четыре валентные связи указанных четырехвалентных атомов углерода Насыщенные валентными связями четырех одновалентных атомов Водород. Достичь физической интерпретации валентности Начнем с самого простого примера — связь двух атомов H водорода до 2 молекул. Давайте рассмотрим два основных атома водорода Стоя (2 S). Когда они сходятся, система может включиться Прогулка в молекулярном состоянии или 3 £ +.
Singlet Этот термин соответствует антисимметричным спиновым волнам. Людмила Фирмаль
Функции и триплетные члены являются симметричными функциями. Куа Напротив, динамическая волновая функция в термине симм Это термин 3E, но термин 3E является антисимметричным. Очевидно основной Только термин XE является термическим термином для молекулы H2. акт Фактически, антисимметричная волновая функция ^ (r i, r 2) (rx, r2— Радиус-вектор обоих электронов) в любом случае Узел (исчезает при Tx = 1 * 2), таким образом Это относится к низшему состоянию системы.
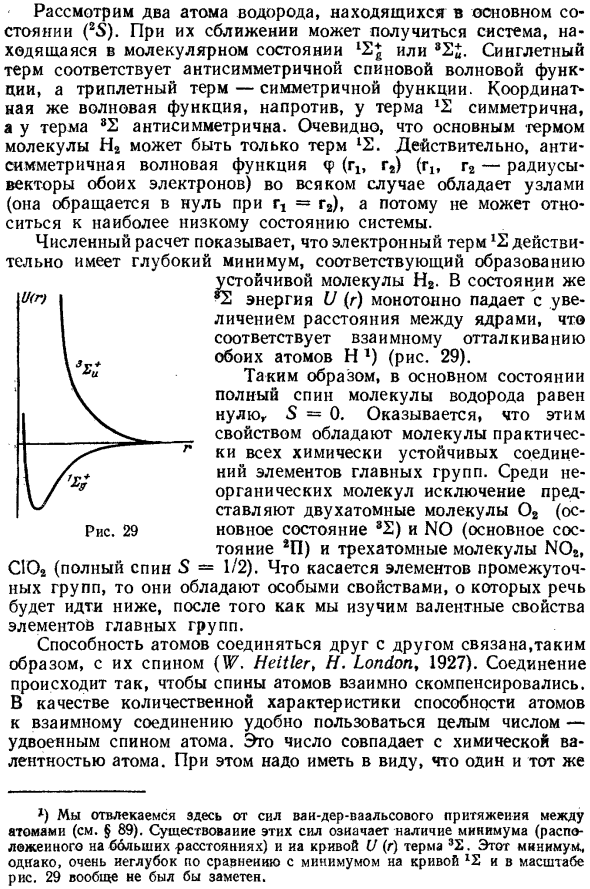
Электронный термин 1E action путем численного расчета Конечно, имеет соответствующий глубокий минимум Образование стабильных молекул H2. В состоянии 3Е энергии gia U (g) монотонно уменьшается с увеличением расстояния Ядра, соответствующие взаимному отталкиванию обоих атомов movН1) (рисунок 29). 1) Здесь мы отвлекаем внимание от силы Ван-дер-Ваальса Атом (см. §89).
Наличие этих сил означает минимальное §81V A L E N T N O S T 379 Таким образом, в основном состоянии, полная спиновая молекула Водород ноль, S = 0. Вы можете видеть, что это ты Молекула обладает практически всеми химически стабильными свойствами. Активные соединения элементов основной группы. В неорганическом Двухатомные молекулы являются исключением ly O 2 (основное состояние 3 E) и N 0 (основное состояние 2 P) И трехатомные молекулы NO 2, СУ2 (пол Спин спин (S = 1/2).
Об элементах Товарищи из средней группы, и они Особая собственность под вопросом Будет ниже после Изу Какая валентность характерна для элемента главы? нью группа. Способность атомов соединяться друг с другом Так что другой связан со сном (W. Heitler, N. London, 1927). Connect Поскольку гений происходит, задняя часть атома Movs взаимно компенсируются.
В качестве Как количественные характеристики Свойства взаимосвязанных атомов Полезные целые числа Удвойте атомное вращение. Это число соответствует химическому Атомарность. То же самое нужно иметь в виду, Атомы могут иметь разные валентности в зависимости от: Из какого государства Рассмотрим основные элементы группы с этой точки зрения. Обычная система.
Первый элемент группы (первый столбец 3, группа щелочных металлов на столе) нормально Спиновое состояние S = 1/2, поэтому их валентность Для единицы. Возбужденные состояния больших спиновых банок Может быть получен только путем возбуждения электронов от воротника Венозная мембрана. Следовательно, эти состояния Достаточно высоко, чтобы предотвратить образование возбужденных атомов Форма стабильных молекул 1).
Атомы элементов второй группы (второй столбец табл. 3, Группа щелочноземельных металлов) Спиновое состояние S = 0. Поэтому нормальное состояние Эти атомы не могут попасть в химическое вещество. один Это относительно близко к основному состоянию Рисунок 29 (Расположен на большом расстоянии) и на кривой U (r) члена 3E.
Это Тем не менее, минимальное значение очень мелкое по сравнению с минимальным значением кривой 1E И по фиговой шкале. 29 вообще не будет выделяться. x) Для элементов Cu, Ag и Ay — см. конец этого раздела. Конфигурация возбуждается пустой оболочкой sp вместо s 2 и общий спин S = 1. Валентность этого атома Состояние 2. Это основная валентность элемента Вторая группа Третья группа элементов в хорошем состоянии.
Электронная конфигурация s2p со спином S = 1/2. но Возбуждая электроны из упакованного 5-слойного слоя Возбужденное состояние с конфигурацией sp2 и вращением S = 3/2, почти нормально. И поэтому Напротив, элементы этой группы ведут себя как одна цена. И как трехвалентно. Кроме того, первый элемент этой группы (B, A1) работает только как трехвалентный.
тенденция Выражение валентности 1 увеличивается с увеличением атомов Т1 ведет себя одинаково как единая цена, Трехвалентные элементы, такие как соединения T1C1 и TCI3. Это первый элемент группы Преимущества высокой энергии связи трех соединений Валентные элементы (по сравнению с одновалентными соединениями Элемент) имеет приоритет над энергией возбуждения атома.
- Для четвертой группы элементов основное состояние Конфигурация Spin 1 s 2p 2 и близкая к ней возбужденная конфигурация состояние — настройка Spin 2 sp3. К этим условиям Соответствует валентностям 2 и 4. Как и в третьей группе, Четвертая группа элементов (C, Si) в основном Высшая валентность (исключения, например, Unity CO) и склонность к проявлению более низкой валентности Увеличение с увеличением атомного номера.
В атоме пятого элемента группы основное состояние области 5 2p 3 конфигурации и спин S = 3/2, соответственно Валентность 3. Возбужденное состояние Вы можете получить большое вращение, только передавая Электронов на оболочку со следующими основными значениями Квантовое число.
Ближайшее такое состояние имеет настройку Приемопередатчик sp3 sf и spin 5 = 5/2 (символ sf Где 5 — состояние электрона с главным квантовым числом. Людмила Фирмаль
Единица больше, чем состояние с). Энергия возбуждается Это состояние относительно большое, но тем не менее Этот атом может связываться со стабильным соединением. соответствующий Таким образом, пятая группа элементов ведет себя как три элемента. И пятивалентный (например, азот NH 3 является трехвалентным, а HNO 3- Пентавалентная).
6 группа элементов основного состояния (конфиг radio s 2p4) Поскольку спин равен 1, атом двухвалентен. Excite Когда один из р-электронов истощается, он переходит в состояние s 2p ^ sf co Спин 2 и еще 5 электронов возбуждения на со §81V A L E N T N O S T 381 Стоящий sp ^ s’p ‘спин 3. в обоих возбужденных состояниях Атом может войти в стабильную молекулу и соответствующие Валентность 4 и 6.
В этом случае шестой первый элемент Группа (кислород) показывает только валентность 2 Высшие элементы группы также показывают более высокую валентность (Таким образом, содержание серы в H 2 S, SO 2 и SO 3 составляет 2, 4, Шестивалентный). 7-я группа основного состояния (галогеновая группа) (Структура s 2p5, спин S = 1/2). Атом одновалентный.
Они Тем не менее, вы можете ввести стабильные соединения и возбужденные состояния Состояние данных конфигурации s 2p 4 sf, s 2p 3 sfpf, sp 3 sfp f2 Со спинами, равными 3/2, 5/2 и 7/2 соответственно Управляет валентностями 3, 5 и 7. Кроме того, первый элемент группы py (F) всегда одновалентна, и следующие элементы указывают Кроме того, более высокие валентности (например, NS 1, NSJ 2, NSJ 3, NSJ 4 составляет 1, 3, 5 и 7 валентности соответственно).
Наконец, атомы элементов группы редких газов Дайте основному состоянию полностью заполненную раковину mi (следовательно, спин S = 0) и их энергия возбуждения велика. Следовательно, валентность равна нулю, и эти элементы Химически инертен 1). Для всех этих соображений вам необходимо: Более общие замечания.
Заявление, которое содержит атом Возбужденно копаться в молекулах с валентными характеристиками му состояние, не предназначенное для размножения атомов Мы, безусловно, взволнованы на большие расстояния Atom. Имеет электронное распределение плота Количество молекул в молекуле находится вокруг ядра конкретного атома Близко к электронному распределению изолированного возбуждения Atom.
Пределы электронов Распределение с увеличением расстояния между ядрами, мес В этом случае он соответствует невозбужденному атому. х) Некоторые из них все еще образуют стабильные соединения (фтор, Кислород). Эти валентности могут быть связаны с электропереходами Новинка из внешней заполненной оболочки с относительно близкой энергией Не заполнено / — (или d ~) состояние.
В нем также упоминаются эффекты уникальной привлекательности, которая возникает, когда: Взаимодействие между атомами благородного газа и их возбужденными атомами. Пункт. Этот эффект связан с удвоением числа возможных состояний Излучение путем восстановления двух разных идентичных атомов Государство (§80).
Переход возбуждения от одного атома к другому В этом случае заменить нормальное обменное взаимодействие Валентность. Примером такой молекулы является молекула HB2. то же Тип связи происходит с двумя одинаковыми молекулярными ионами Атом (H ^ и т. Д.) Когда атом связан с молекулой, он заполнен электронами Атомная оболочка практически не изменилась.
Распределение элек Толщина незаполненной оболочки Чтобы резко измениться. В самом заметном случае Все валентные электроны так называемых гетерополярных связей Переходя от одного атома к другому, так что мы можем сказать, Числитель (в единицах Е) его валентность. Элементы первой группы электричества Живые гетерополярные соединения излучают электричество Форма катионов.
При переходе к следующему Групповая позитивность постепенно снижается и переходы Для электроотрицательности, Седьмой элемент группы. О разной полярности Сделайте те же замечания о возможности Стимулированный атом в молекуле. Если молекула является гетерополярной, Это когда атомы размножаются Получите два иона.
Итак, мы действуем из молекулы CsF Ионы Cs + и F- полностью получены, но молекула NaF Na и F нейтральные атомы (из-за сродства фтора Электроны имеют потенциал ионизации цезия, Потенциал ионизации натрия низкий). В случае ограничений, противоположных так называемым Мезополярная связь, атомы в молекуле остаются в среднем Troll. В отличие от гомеополярных молекул Целлопола, без большого дипольного момента Объем.
Разница между гетерополярным и гомеополярным общением Чисто количественный, все переходные Случай. Далее рассмотрим элементы промежуточной группы. Иер Палладий и полицейские платиновой группы из-за валентности Свойства сильно отличаются от основных элементов группы. разница Для относительно глубокой гонки Положение c электронов в атоме, они взаимодействуют слабее Другие атомы в молекуле.
В результате Отношения между этими элементами относительно распространены Насыщенное соединение с отличными молекулами От нулевого вращения (на самом деле не более 1/2). каждый Кроме того, это может указывать различные валентности элемента Здесь может быть одно различие, а не только два.
Понравились элементы основной группы (здесь Связано с компенсированным электронным возбуждением Spin, в результате, спин пары выпускается сразу Электроны). Элементы редкоземельной группы Бланк / -оболочка. / -Есть много электронов §81B A L E N T N O S T 383 Более глубоко? -Потому что это электронное Валентность. Следовательно, редкоземельная валентность Элементы определяются только s и p электронами Венозная мембрана 1).
Тем не менее, когда взволнован Атомное расщепление, f электроны могут переходить в s и p состояния. В результате валентность увеличивается на единицу. Поэтому красный Земные элементы показывают разные валентности За единицу (по существу, все трехвалентное и четырехвалентное). Активный элемент группы занимает уникальную позицию.
Ния. Ac и Th не содержат / -электронов и их валентности п относится к электронам. Поэтому его химия По своим свойствам они аналогичны элементам группы палладия и платины Однако это не редкая земля. Для урана, В нормальных условиях атом U содержит / -электроны, В соединениях он не имеет / -электронов. На последнем атоме Элементарные Np, Pu, Am, Cm накопители / -в электронах и соединениях Но участвуя в валентных электронах, они х и с электроны.
В этом смысле они похожи на уран. «Непарный» максимальное количество s- и c? новый 1 и 5 соответственно. Поэтому максимальная валентность Количество элементов в группе актиния составляет 6 Максимальная валентность редкоземельных элементов, Валентные s и p-электроны составляют 1 + 3 = 4).
Элементы группы железа заняты своей валентностью Свойство промежуточного положения между редкими землями Элементы и элементы группы палладия и платины. На этом атоме Макс с? Электроны относительно глубокие и обычно расположены Многие соединения вообще не участвуют в валентных связях Смотрите, следовательно, в этих соединениях элементы группы железа Действует как редкая земля.
К ним относятся Ионные соединения (FeCl2, ReС1з и др.) Атомы металла входят как простые катионы. редкий Элементы земли, элементы группы железа в этих соединениях Появляется самая разнообразная валентность. Другим типом соединения элемента группы железа является Так называемые комплексные соединения.
Они персонажи Характеризуется тем, что содержит атомы промежуточных элементов Молекулы не простые ионные формы, они являются частью комплекса Сложные ионы (например, ионы MnO2 в CMP 04, ионы Fe (CN) 6 «в K4 Fe (CN) г). В таких сложных ионах атомы x) c электронов, присутствующих в неизолированной оболочке некоторых атомов Из редких земель эти атомы на самом деле Мы всегда участвуем в таком волнении Других с-электронов нет.
Расположены ближе друг к другу, чем простые ионы Облигации, и среди них β-электроны, участвуют в валентности Ноя связь. Поэтому сложные соединения Элементы группы железа ведут себя как элементы группы Палладий и платина. Наконец, C, Ag, Ay, § 73, отнесенный к основным группам, со многими соединениями Выступать в качестве промежуточного звена.
Эти элементы могут быть указаны Валентность больше 1 из-за электрического перехода Новое от β-оболочки до энергии p-оболочки (например, С на 3d на 4р). В таких соединениях атомы не расщеплены. Выступать в качестве промежуточного звена в оболочке b (C-метод Элементы группы Fe, Ag, Ay — как элементы групп Pd и Pt).
Определите и получите электронный термин молекулярного иона H ^ При соединении атома водорода в нормальном состоянии с ионом Н +, Расстояние R (по сравнению с радиусом Бора) Kernel (Л.Д. Ландау, 1961; S. Herring, 1961) d). Решение Эта проблема аналогична проблеме 3§50 в заявлении.
Вместо двух одномерных потенциальных ям, два трехмерных Скважина с общей осевой симметрией (вокруг двух сердечников) Линия, соединяющая ядра. Уровень Eo = —1/2 (базовый уровень атома Длина) 2) разделена на два уровня: Ug (R) и UU (R) (термины 2E + и 2 £ +), Совместим с электронными волновыми функциями ipg, n (x, y, z) = — ^ = [i p o (x, y, z) ± 4> o (-x, y, z)].
Симметричный и асимметричный относительно плоскости x = 0, деление На половине расстояния между ядрами (находится в точке х = ± R / 2 ось х). Где φо (х, у, г) — волновая функция электронов в одном из потенциалов. Arupitto. Полностью похож на метод, выполненный в Задаче 3 § 50, получить U g, u (R) -Е0 = ТJ JФо ^ -d y d z, (1) Интегрирование выполняется вдоль плоскости х = 0 3).
г) Решение аналогичных задач с молекулами H2 — см. Л. П. Горьков Л.П. Питаевский // ДАН СССР 1963. Т. 151.П. 822; С. Херринг, М. Мерцание // Пастор физики, 1964. Т. 134А. С. 362 (в данном случае вторая статья Начали с первой ошибки расчета). 2) Для этой проблемы используйте атомные единицы.
3) Подчеркните, что таким образом определяется желаемый эффект Расстояние, на котором электроны взаимодействуют одинаково с обоими Ядро. §8 2 B A L E N T N O S T 385 Четыре функции (например, соответствующие движению вокруг сердечника 1, Прогулка в точке х = R / 2) Φ0 = — ^ = e-Γ1, (2) V ^ R Где а — медленно меняющаяся функция (водород имеет а = 1).
Функция φ должна удовлетворять уравнению Шредингера 2 \ 2 R n r2J + = ° (3) (Ri, r2 — расстояние электронов от ядер 1 и 2) как полная энергия Электрон в этом уравнении является разностью Eo-1 / R. 1 / R энергия ядерной кулоновской улосической силы также включена. Поскольку функция φо быстро убывает с расстоянием от оси x, Только области, где значения y и z малы (по сравнению с R), важны в (1).
Если y, z <R, то заменить (2) на (3) Да ^ а-о дх р / 2 + х р (Игнорирование второй производной медленно меняющейся функции а и г2 ~ р / 2 + х). Решение этого уравнения x R / 2 единицы (то есть около сердечника 1), 2R (х 1 a = ———- e x p ———- R + 2x \ R 2 Официальный (1) дать сейчас о U g, u-E 0 = T- [e “2ri • 2nn d n = = f2R e ~ R ~ \ время R / 2 Разделенное количество 1) Ug-U u = -4 R e к R- \ (4)
На достаточно больших расстояниях это уменьшается экспоненциально Выражение меньше, чем эффект второго приближения диполя. Взаимодействие атома Н и иона Н +. От атомной поляризуемости Нормальное состояние водорода составляет 9/2 (см. (77,9)), а поле ионов H + S = 1 / -R2, и соответствующая энергия взаимодействия равна –9 / (4 R 4)
Думай о ней U g, u (Я) -Ео = F2Де — * — 1-. (5) Второй член сравнивается с первым членом только при R = 10,8. Также показывает Термин UU (R) имеет минимальное значение -5,8 • 105 при R = 12,6. блок (-1, 6 -1CG3 эВ) 2). 1) Аналогичные результаты для молекул Hg (см. Статью выше): Ug-Uu = -1,64R 5 / 2e ~ 2R. 2)
Это минимальное значение, связанное с силами Ван-дер-Ваальса, Сторона по сравнению с минимальным значением члена Ug (R), соответствующим Новое состояние стабильных ионов H ^, этот основной минимум R = 2,0 составляет -0,60 ат. Единица (-16,3 эВ).
Смотрите также:
| Пересечение электронных термов | Колебательная и вращательная структуры синглетных термов двухатомной молекулы |
| Связь молекулярных термов с атомными | Мультиплетные термы. Случай a |
Если вам потребуется заказать решение по физике вы всегда можете написать мне в whatsapp.
