Оглавление:



Выражение количества теплоты через параметры состояния и через их изменение в термодинамическом процессе. Энтропия
- Детальное изучение энергообмена в различных формах показывает, что не только количество механической работы, но и количество энергии, передаваемой в других формах, может быть выражено математически двумя физическими величинами, соответствующими энергообмену в той или иной форме. Внешний вид таких формул аналогичен формулам 3.1 и 3.2. В формуле количества теплоты величиной, характеризующей причину теплообмена, является абсолютная температура T. 2. Вторая величина гораздо сложнее в физическом смысле-как и объем, является признаком теплообмена. Долгое время изменение температуры считалось признаком теплопередачи. Но оказывается, что это не так.
Например, достаточно вспомнить, что при кипячении горячей воды подается большое количество тепла, но температура остается постоянной. Когда жидкость затвердевает, тепло отводится, но это не приводит к падению температуры до тех пор, пока вся жидкость не превратится в crystals. In в этих примерах температура не изменяется из-за теплопередачи. С другой стороны, если газ сжат в баллоне, температура газа будет увеличиваться, но тепло может быть удалено, даже если стенки баллона находятся cold. In в данном примере изменение температуры вызвано не теплопередачей, а механической работой.
При помощи дымчатого стекла кажущейся интенсивности можно придать такую величину, к которой человеческий глаз наиболее чувствителен. Людмила Фирмаль
После детального научного анализа изменений, наблюдаемых в системе при обмене тепловой энергией, физические величины, в которых изменения фактически являются признаками теплопередачи, были открыты в 1852 году немецким физиком Р. S. It был показан только Клаузиусом. Позднее эта физическая величина получила название энтропии. Энтропия-это физическая величина, изменение которой является признаком энергетического обмена в виде тепла. Главной особенностью энтропии как термодинамической величины является то, что энтропия неизбежно изменяется при наличии теплопередачи. Когда тепло подается в термодинамическую систему, энтропия системы увеличивается и уменьшается, как это removed.
- Кроме теплопередачи, другие воздействия на систему не могут изменить величину энтропии 1. Основная трудность в понимании физического смысла энтропии заключается в том, что она не может быть измерена, поскольку энтропия не влияет на измерительный прибор, например, как это происходит при давлении или объеме. Тогда указывается, что только изменение энтропии может быть вычислено из изменений параметров давления, температуры, объема, которые могут быть измерены непосредственно в системе. system.
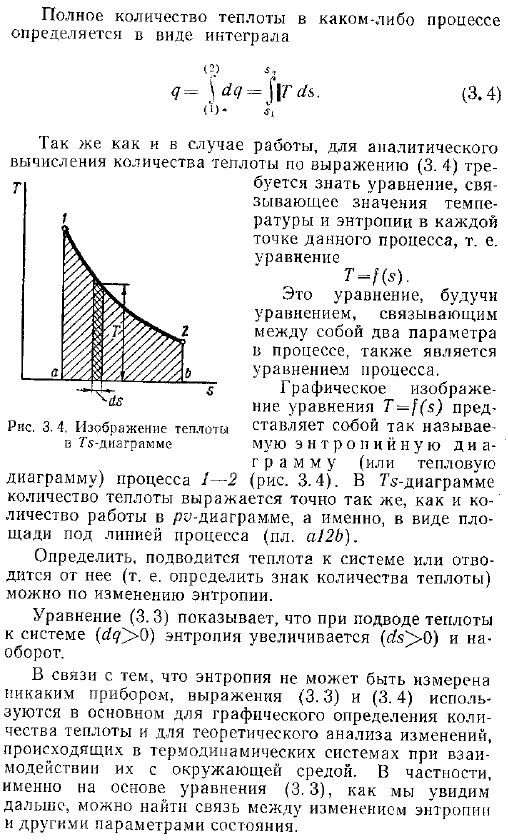
Энтропия является функцией состояния термодинамической системы. Отношение между количеством тепла и изменением энтропии такое же, как отношение между количеством работы и изменением объема системы. Теплота равна произведению абсолютной температуры системы и изменения энтропии системы. 14 Т41. 3. Три 3 в этом случае ссылаются только на так называемый процесс equal-11s. Это обсуждается в разделе 3.4. Общее количество тепла в любом процессе определяется как Интеграл 7 Г Л. 3.4 Б- Как и в случае работы, Формула 3. 4 для анализа количества тепла путем расчета РПС. 3. 4.
Ток накала нити, регистрируемый измерительным прибором Л, соответственно калиброванным, является показателем интенсивности излучения предмета. Людмила Фирмаль
Тепловое изображение диаграммы ту Необходимо знать уравнения, связанные со значениями температуры и энтропии в каждой точке данного процесса, то есть уравнения. ТПС. Это уравнение является уравнением, которое соединяет 2 параметра в процессе, а также уравнение процесса. Графическое изображение уравнения Т — представляет собой так называемую диаграмму энтропии или теплоты рис. 3.4. на диаграмме Схема процесса 1-2, количество теплоты выражается точно так же, как и работа круговой диаграммы, то есть в виде площади под линией процесса квадрат а 2б. Изменяя энтропию, можно определить, поступает ли в систему тепло или удаляется из системы то есть можно определить знак количества тепла.
Уравнение 3.3 показывает, что при подаче в систему тепла b 0 энтропия возрастает 0. Поскольку энтропия не может быть измерена никаким прибором, формулы 3.3 и 3.4 в основном используются для графического определения количества теплоты и для теоретического анализа изменений в термодинамических системах при взаимодействии с environment.
Смотрите также:
