Оглавление:

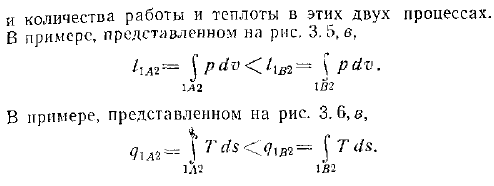

Зависимость количества работы и теплоты от характера термодинамического процесса
- Используя параметры состояния системы, а также графическое представление в диаграммах RU и G, можно легко показать, что количество работы и тепла зависит от характера процесса, если выразить количество работы и тепла. Вне процесса 1 понятие тепла и работы не имеет смысла. Потому что он не указывает запас энергии, а только количество энергии, переданной в процессе.
Физически характер процесса зависит от соотношения количества работы и теплоты, и система меняет свое состояние в обмен на окружающую среду. Аналитически различие в природе процесса представлено разницей между уравнениями и различными процессами. Из формул 3.2 и 3.4 видно, что для определения количества работы и теплоты возьмем Интеграл необходимо иметь свойства процесса в виде уравнений p y и T 8.Поэтому количество работы и тепла зависит от характера процесса.
Поместив с одной стороны окрашенного натрием пламени абсолютно черное тело и наблюдая с помощью спектроскопа, установленного с другой стороны пламени, черное тело, будем видеть непрерывный-спектр излучения. Людмила Фирмаль
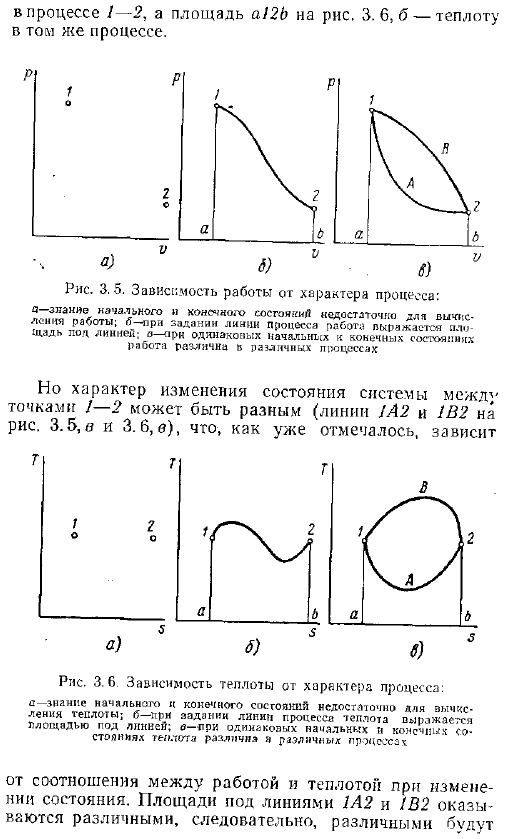
Графически различие в характере процесса представлено тем, что различные процессы представлены различными кривыми диаграммы состояния. А так как рабочий объем круговой диаграммы и количество тепла на рисунке 7 долларов представлены в виде областей под технологической линией, то на этих рисунках зависимость рабочего объема и количества тепла от характера процесса наиболее очевидна. Фактически на диаграмме рис. 3.5, А и 3.6, а эти состояния представлены точками и 2, Если рассматривать систему в 2-х конкретных состояниях, которые характеризуются конкретными значениями параметров и состояний functions.
- В то же время на диаграмме нет линии, соединяющей точки 1 и 2, поэтому область под ней будет работать следовательно, T. в диаграмме это будет тепло. Когда система обменивается теплом и переходит из состояния 1 в состояние 2 в координации с окружающей средой, это изменение представлено линиями диаграммы состояния, такими как линии 1-2 см. Рисунки 3.5.6 и 3.6.6.в этом случае объем работы и количество тепла представлены в виде области на диаграммах ro и PM соответственно. Например, рисунок A. 12b область.
Рабочий процесс 1-2 и рисунок а Определите область 2b. 3. 6, B-нагревание в том же процессе. Рисунок 3.5.Зависимость работы от характера процесса CONSCIOбыл составлен Это не достаточно, чтобы рассчитать работу. o-при настройке технологической линии работа представляет собой область под линией. in-от одного и того же начального состояния до конечного состояния работа зависит от процесса Однако характер изменения состояния системы между точками 1-2 может быть различным рисунки 3.5, c и 3.6, c A2 и 1132 линии. Рисунок 3.6 зависимость теплоты от характера процесса а-знание начального и конечного состояний недостаточно для расчета теплоты.
Обычно цветной фильтр является красным (Хг —0,665 мк) и прибор регистрирует кажущуюся монохроматическую температуру. Людмила Фирмаль
При настройке технологической линии теплота представлена областью под линией. c-для идентичных начальных и N конечных состояний o тепло-это другой процесс О соотношении работы и тепла, когда меняется состояние. Области ниже линий 1L2 и 1B2 оказались разными, поэтому эти 2 рабочих нагрузки и теплотворные способности отличаются. В 3.5, в примере, показанном на рисунке Лактаптина rl2 pYT1.
Смотрите также:
