Защита металлов от коррозии
Широко применяются следующие основные методы защиты металлов от коррозии:
1. Защитные покрытия. Основным методом борьбы с коррозией является изоляция металла от агрессивной среды с помощью различных покрытий. Различают три основные группы защитных покрытий: металлические, неметаллические, химические.
Металлические покрытия. Металл покрывают другим металлом, наиболее стойким против коррозии в данных условиях. Защищающими служат следующие металлы: 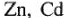 ,
, 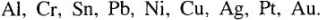 . По роли каждого из них в гальванопаре с защищаемым металлом различают покрытия анодные и катодные. Слой защищаемого металла должен быть сплошным и беспористым для изоляции защищаемого металла от коррозии.
. По роли каждого из них в гальванопаре с защищаемым металлом различают покрытия анодные и катодные. Слой защищаемого металла должен быть сплошным и беспористым для изоляции защищаемого металла от коррозии.
При нарушении целостности покрытия к защищаемому металлу проникает раствор электролита, вызывая образование гальванического элемента.
Если защищающий металл является более активным, чем защищаемый (например, покрытие железа цинком), то защищающий металл (цинк) служит анодом и поэтому разрушается, а покрываемый металл служит катодом, т.е. остается защищенным до тех пор, пока не будет разрушен весь защитный слой.
Работа гальванических элементов в этом случае идет по схеме:
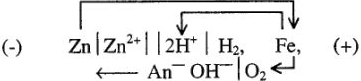
Металлы, имеющие больший потенциал, образуют катодные покрытия. Это значит, что даже при малейшем повреждении покрытия защищаемый металл будет усиленно коррозировать. Примером может служить луженое, т.е. покрытое оловом железо. Олово хорошо защищает железо только до тех пор, пока защитный слой является сплошным, без трещин. Если же часть поверхности железа обнажится и придет в соприкосновение с раствором электролита, то железо будет коррозировать, причем гораздо быстрее, чем нелуженое:
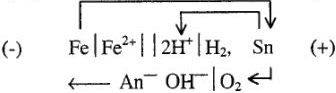
Существует несколько способов нанесения одних металлов на поверхность других, из которых наиболее распространенным является гальванический, или электрохимический метод, т.е. метод осаждения металла с помощью электрического тока (электроосаждение).
Неметаллические покрытия. Сюда относятся покрытия изделий лаками, красками, резиной, бакелитом, эмалью, битумом. На поверхности защищаемого металла при эт*ом создается сплошная пленка, предохраняющая металл от действия окружающей среды.
Для борьбы с коррозией широко используются пластмассовые защитные покрытия на основе поливинилхлорида — винилластовая пленка, пластикат, асбови-ниловая масса и др.
Химические покрытия. Поверхность защищаемого металла подвергается определенной химической обработке с целью получения на нем пленки его химического соединения, стойкой против коррозии.
По своему составу защитные пленки подразделяются на оксидные, фосфатные, хроматные и др. Для оксидирования (получения оксидной пленки) используют различные окислители (концентрированные 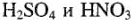 и др.). Оксидирование стали называют воронением, так как поверхность металла приобретает в этом случае синюю или черную окраску (цвет «воронова крыла»). Оксидирование применяют также для защиты от коррозии алюминиевых сплавов.
и др.). Оксидирование стали называют воронением, так как поверхность металла приобретает в этом случае синюю или черную окраску (цвет «воронова крыла»). Оксидирование применяют также для защиты от коррозии алюминиевых сплавов.
Фосфатирование — обработка стальных изделий при определенных условиях солями фосфорной кислоты — дает прочное покрытие (фосфат железа практически нерастворим в воде).
2. Обработка коррозионной среды. Иногда защита металла достигается удалением вредных примесей из окружающей его среды. Примером может служить удаление растворенного кислорода из воды, питавшей паровые котлы, что значительно удлиняет срок их службы. Добавляют в коррозионную среду вещества, снижающие скорость коррозии металлов. Такие вещества называются ингибиторами (замедлителями). Ингибиторное действие ярко выражено у таких типов соединений, как амины, мочевина, тиомочевина, сульфиды, альдегиды и др. Эффективными ингибиторами являются многие природные органические соединения и продукты их переработки. По условиям применения ингибиторы коррозии можно разделить на ингибиторы для водных растворов (кислотные, щелочные и для нейтральных сред) и ингибиторы для защиты от атмосферной коррозии («летучие» ингибиторы). Ингибиторы, адсорбируясь на коррозиирующей поверхности, тормозят анодный (анодные ингибиторы) или катодный (катодные ингибиторы) процессы. Могут быть ингибиторы смешанного типа. Ингибиторы снижают агрессивность коррозионной среды (например, путем связывания активного кислорода при котельной коррозии).
3. Электрохимические методы защиты. Сущность этих методов заключается в том, что вся поверхность подлежащего защите металлического сооружения становится катодом (катодная защита). Катодная защита применима только в токопроводящей среде и осуществляется в основном двумя способами.
Протекторная защита. Защищаемый металл (например, 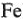 ) приводят в контакт с другим металлом (
) приводят в контакт с другим металлом ( ), имеющим более отрицательный электродный потенциал, чем металл защищаемой конструкции. Более активный металл называется протектором (защитником). В образовавшейся гальванопаре протектор является анодом и постепенно разрушается, а защищаемая конструкция — катодом. Для протекторной защиты стали чаще всего используют цинк.
), имеющим более отрицательный электродный потенциал, чем металл защищаемой конструкции. Более активный металл называется протектором (защитником). В образовавшейся гальванопаре протектор является анодом и постепенно разрушается, а защищаемая конструкция — катодом. Для протекторной защиты стали чаще всего используют цинк.
Электрозащита. Защищаемое сооружение присоединяют к катоду внешнего источника постоянного тока. В качестве анода используют дополнительный электрод (металлический лом), который подвергается разрушению, предохраняя тем самым от коррозии защищаемое сооружение.
При помощи катодной защиты предохраняют от коррозии подземные и подводные трубопроводы, силовые кабели и кабели связи, морские суда и др. Электрозащита имеет существенное преимущество перед протекторной защитой. Так, радиус действия последней приблизительно равен 50 м. Поэтому при необходимости защиты большой поверхности металла требуется целая серия протекторов. Радиус же действия катодной защиты составляет 2000 м.
4. Разработка и производство новых металлических конструкционных материалов повышенной коррозионной устойчивости путем устранения из металла или сплава примесей, ускоряющих коррозионный процесс (устранение железа из магниевых или алюминиевых сплавов, серы из железных сплавов и т.д.), или введения в сплав новых компонентов, сильно повышающих коррозионную устойчивость (например, хрома более 12 % — в железо, марганца — в магниевые сплавы, никеля — в железные сплавы, меди — в никелевые сплавы и т.д.).
5. Переход в ряде конструкций от металлических к химическим материолам (пластические высокополимерные материалы, стекло, керамика и др).
6. Рациональное конструирование и эксплуатация металлических сооружений и деталей (исключение неблагоприятных металлических контактов или их изоляция -устранение щелей, зазоров в конструкции, устранение зон застоя влаги и др.).
Эта теория взята со страницы подробного решения задач по всем темам химии:
Возможно эти страницы вам помогут:
| Выход по току в химии |
| Коррозия металлов в химии |
| Комплексные соединения в химии |
| Химия элементов |
