Коррозия металлов с кислородной деполяризацией
Процессы коррозии металлов, у которых катодная деполяризация осуществляется растворенным в электролизе кислородом, называется коррозией металлов с кислородной деполяризацией. Катодная деполяризация происходит по следующим схемам:
а) в нейтральных и щелочных растворах
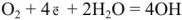
б) в кислых растворах
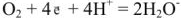
Самопроизвольное протекание коррозии металла с кислородной деполяризацией согласно уравнению возможно, если:
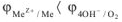
Величина равновесного электронного потенциала кислорода зависит от кислотности среды и парциального давления кислорода и может быть рассчитана по уравнению
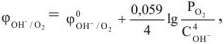
где 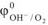 — стандартный электродный потенциал кислорода,
— стандартный электродный потенциал кислорода,
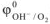 = + 0,401 В
= + 0,401 В
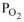 — парциальное давление кислорода в атмосфере,
— парциальное давление кислорода в атмосфере, 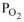 = 21278 Па (0,21 атм.)
= 21278 Па (0,21 атм.)
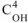
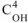 — молярная концентрация ионов гидроксида в растворе, моль/л.
— молярная концентрация ионов гидроксида в растворе, моль/л.
В соответствии с уравнением (22) в щелочной среде при
pH = 14 (С = 1 моль/л) 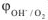 = + 0,391 В, в нейтральной среде при
= + 0,391 В, в нейтральной среде при
pH = 7 (С =10 моль/л) 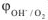 = + 0,805 В, в кислой среде при
= + 0,805 В, в кислой среде при
рН = °(соН-= Ю14 моль/л) 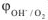 =+1,218В.
=+1,218В.
Как видно из приведенных данных электродный потенциал восстановления кислорода 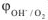 при всех значениях pH является положительным и сильно возрастает с увеличением кислотности среды. Следовательно, кислород является сильным окислителем во всех средах, и его окисляющая способность существенно усиливается в кислой среде. Так, как у большинства металлов электродные потенциалы <рМс,. много меньше, чем потенциал восстановления кислорода, то в растворах электролитах в присутствии кислорода большинство металлов неустойчиво и может подвергаться коррозии. Коррозия с кислородной деполяризацией — самый распространенный коррозионный процесс. По этому механизму протекает атмосферная коррозия, коррозия в среде электролитов, почвенная коррозия и другие виды коррозии.
при всех значениях pH является положительным и сильно возрастает с увеличением кислотности среды. Следовательно, кислород является сильным окислителем во всех средах, и его окисляющая способность существенно усиливается в кислой среде. Так, как у большинства металлов электродные потенциалы <рМс,. много меньше, чем потенциал восстановления кислорода, то в растворах электролитах в присутствии кислорода большинство металлов неустойчиво и может подвергаться коррозии. Коррозия с кислородной деполяризацией — самый распространенный коррозионный процесс. По этому механизму протекает атмосферная коррозия, коррозия в среде электролитов, почвенная коррозия и другие виды коррозии.
Рассмотрим схему электрохимической коррозии с кислородной деполяризацией.
Эта теория взята со страницы помощи по химии:
Возможно эти страницы вам помогут:
| Химическая коррозия в химии |
| Электрохимическая коррозия в химии |
| Некоторые правила определения степеней окисления элементов в химических соединениях |
| Оксиды. Классификация. Свойства. Номенклатура |
