Оглавление:
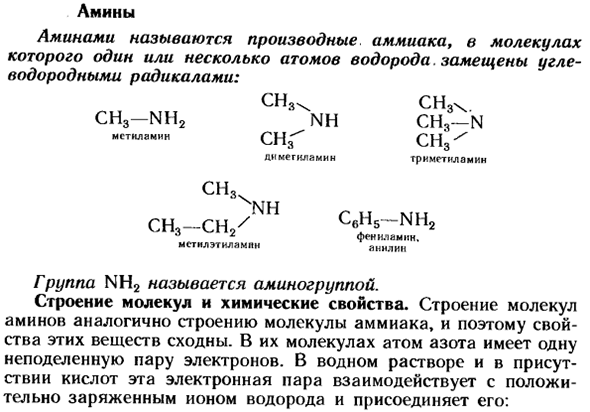




Амины
- Амин. Амины-производные аммиака, молекулы, в которых 1 или более атомов водорода замещены углеводородными радикалами. СН3 \ СН3. CH3-NH2 NH CH3-N QHf метиламин СН3 ^ Диметакрамин, триметиламин CH3x SI-SI / C6HS-NH2 ^ P3 ^ ^ P2 фенол или Амин、 Анилин тирамина м-стиля Группа NH2 называется аминогруппой. Молекулярная структура и химические свойства. Структура молекулы Амина аналогична структуре молекулы аммиака, поэтому свойства этих веществ таковы similar.
- In те молекулы, атом азота имеют 1 одиночную пару electrons. In в водных растворах и в присутствии кислот эта электронная пара взаимодействует и соединяется с положительно заряженными ионами водорода. H3N:+ HOH ^ [NHJ + + OH » * Юн аммоний H3C-H2N: — f HOH [H3C-NH3] f + OH » Не метиламмония H3N:+ H f + CI » — > [NH41 fCl Хлористый аммоний H3C-H2N:+ H f + SG — * [H3C-NH3] + C1〜 Хлористый метиламмоний Поэтому аммиак и Амины обладают основными свойствами.
Их водный раствор окрашивает лакмусовый раствор в синий цвет, а раствор фенолфталеина окрашивается малиной. Людмила Фирмаль
Однако, по сравнению с аммиаком, Амины являются более сильными основаниями. Это связано с различием в структуре молекулы. Если электронное облако сдвигается от 3 атомов водорода к азоту в молекуле аммиака, например, в молекуле метиламина CH3-NH2, электронное облако от 5 атомов водорода сдвигается к атому азота(непосредственно от 2 атомов водорода, через 3 атома углерода). (Стрелка указывает на смещение электронной плотности от атома водорода к атому азота.)
В результате атом азота молекулы метиламина приобретает больший отрицательный заряд, чем атом азота молекулы аммиака. Из-за чрезмерного отрицательного заряда атом азота молекулы Амина притягивает больше протонов, чем молекула аммиака. То есть Амины проявляют более сильную основность. Наибольшую практическую ценность представляет ароматический амин-инхлин.
Структура молекул анилина может быть представлена несколькими способами. :nн 2: nн 2 c6hf-nн 2 НС ^ с / C hcWCH ЖЖ х н — ^ ы-ы: Икс♦ Н. Н. Н. Производство анилина в промышленности основано на реакции восстановления нитробензола, которая была открыта в 1842 году русским ученым Н. Н. Зининым. Нитробензол уменьшается в присутствии чугунной стружки и соляной кислоты. Атомарный водород сначала выделяется и взаимодействует с нитробензолом.
Fe + 2CH1 FeCI2 + 2H С6Н5-N02 +6НС6Н5— NH2 + 2Н20 Физические характеристики. Анилин-бесцветная маслянистая токсичная жидкость, слабо растворимая в воде. Подходящими растворителями для него являются спирт, эфир, бензол. Анилин затвердевает при −6 ° C и кипит при 174 ° C. Из-за его окисления на воздухе он быстро темнеет. Химическая природа анилина обусловлена наличием в молекуле аминогрупп-NH2 и бензольного ядра.
Подобно аминам, производным углеводородов маргинального ряда, анилин реагирует с кислотами с образованием солей, но не изменяет окраску лакмуса. Поэтому анилин является более слабым основанием, чем Амины в ограниченной серии. Как это можно объяснить? Чтобы ответить на этот вопрос, вспомним взаимное влияние атомов и групп атомов в молекуле(с. 187).
- Подобно молекуле фенола (стр. 214), ядро бензола оттягивает некоторые пары свободных электронов от атома азота амино group. As в результате электронная плотность атома азота в молекуле анилина уменьшается, что более слабо притягивает протоны. То есть он ослабляет основные свойства анилина. Наиболее важные химические свойства анилина приведены в таблице 89. Таблица 89.
Важнейшие химические свойства анилина Химические свойства анилина обусловлены его присутствием в молекуле ядро бензола ilmhhoipyillu Реагируют с кислотами с образованием солей: Q! Соли i5-NH,+ 1 CeI 1sNi iacl, образованные хлоридом фениламмония, вступают в реакцию со щелочью, и анилин снова высвобождается. Триброманилин: NHo A и HC ^ CH BrC / ^ t-CBr n (19 / n +ЗВГг1Ф + MG 3 броманилин Приложение.
Под действием окислителя на анилин последовательно образуются вещества различных цветов. Людмила Фирмаль
Большая часть анилина используется в производстве красителей. Поэтому, например, получают так называемый черный анилин. Кроме того, анилин является исходным материалом для синтеза многих фармацевтических субстанций, например, сульфаниламидных препаратов, анилиноформальдегидных смол и некоторых взрывчатых веществ.
Генетическая ассоциация анилина с другими классами органических соединений. Анилин может быть получен из различных углеводородов. Ч ^ CjHjx C6H » — CeHsN02 C6HSNH、 QH. ф Ответьте на вопрос, упражнение 1-9 (стр. 263). «Задача 1-3 (стр. 266).
Смотрите также:
| Крахмал | Аминокислоты |
| Целлюлоза | Белки |
Если вам потребуется помощь по химии вы всегда можете написать мне в whatsapp.
