Оглавление:






Аммиак
- Аммиак Глава VII§ 2.Повторите от. Строение молекулы. Химическая формула аммиака-H3N. поскольку азот является электроотрицательным элементом больше, чем водород(I, с. 123), химическая связь молекулы аммиака является ковалентной связью. Н Поляков(I, с. Электронный H: N аммиака:、 Н. Н. Н. Структурная формула H-N. Я Н
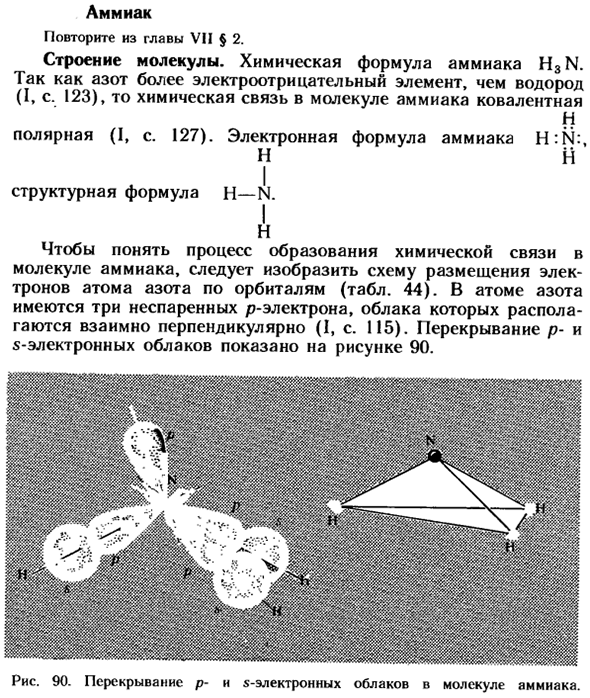
- Чтобы понять процесс образования химических связей в молекулах аммиака, необходимо нарисовать расположение электронов атомов азота на орбиталях (табл. 44).перекрытие облака P-электронов и облака s-электронов показано на рисунке 90. Рисунок 90.
Атом азота имеет 3 неспаренных Р-электрона, облака которых перпендикулярны друг другу(I, с. 115). Людмила Фирмаль
An перекрытие электронного облака P и s в молекуле аммиака. Мы получили ваши отзывы. Из курса биологии известно, что азот входит в состав белковых веществ, благодаря которым в растениях, животных и человеческих организмах осуществляются важнейшие жизненные процессы. Однако ни животные, ни растения не могут напрямую связываться с атмосферным азотом(за исключением бобовых, в корнях есть азотные бактерии, которые могут поглощать атмосферный азот (1)).
Большинство растений усваивают азот только из своих соединений (нитратов, аммиачной воды, солей аммония), а животные-из растительной пищи. Долгое время потребность в связанном азоте финансировалась за счет импорта нитратов из природных источников (нитрат натрия), но их запасы по-прежнему ограничены.
Поэтому перед учеными встала проблема поиска наиболее экономически выгодных способов комбинирования атмосферных nitrogen. It оказывается, этот метод заключается в синтезе аммиака из азота и водорода. N2 + ZN2 * * 2H3N + Q Однако, ученые столкнулись со многими трудностями в реализации этой реакции на практике. Преодоление их является показательным примером роли науки в технологическом прогрессе.
Принцип сдвига химического равновесия (I, с. 165)позволяет прогнозировать наиболее благоприятные условия для осуществления синтеза аммиака. Эта реакция экзотермична и протекает с уменьшением объема, поэтому, по возможности, ее следует проводить при более низких температурах и при высоком давлении. Но здесь возникают и другие трудности: даже при температуре 400°С скорость реакции оказывается недостаточной для выполнения в промышленных масштабах, а повышение температуры снижает выход аммиака.
Ученые могут до некоторой степени устранить это температурное несоответствие, используя катализаторы, которые увеличивают количество активных молекул и тем самым увеличивают скорость химических реакций при данной температуре. Эти катализаторы позволяют синтезировать аммиак при 450-500°с, но при 500°С и атмосферном давлении эта температура слишком высока, так как только 0,1% азотно-водородной смеси превращается в аммиак.
Поэтому необходимо найти более активный катализатор, способный синтезировать аммиак при более низкой температуре. Эта проблема до сих пор не решена. Поэтому необходимо увеличить выход аммиака за счет повышения давления, но это значительно увеличивает стоимость строительства синтетической колонны. Влияние температуры и давления на выход аммиака в равновесном состоянии показано в таблице 45. 1.
В почве есть свободные живые бактерии, которые могут поглощать атмосферный азот. Такие бактерии можно выращивать искусственно, а бактериальные удобрения получать из них. Таблица 45.Выход аммиака при равновесном состоянии обратимой реакции Давление выход аммиака при температуре («C»)(%) (В МПА) 400 450 500 550 10 25.12 16.43 10.61 6.82 30 47.00 35.82 26.44 19.13 100 79.82 69.69 57.47 41.16 В настоящее время синтез в промышленности осуществляется синтетической колонной (цветной) высотой до 20 м.
II) в присутствии катализатора (порошкообразное железо, смешанное с оксидом алюминия и оксидом калия).Синтез протекает при высокой температуре (450-500°С) и высоком давлении (30-100 МПА) 1,эти колонны изготовлены из специальной сортовой стали. Кроме того, при проектировании колонны синтеза аммиака между цилиндрической коробкой, содержащей катализатор, и корпусом колонны остается зазор, так что материал может сохранять свою прочность в течение длительного времени при такой высокой температуре и давлении(рис. ВТОРОЙ.)
Смесь холодного азота и водорода поступает в колонну синтеза из этого зазора, защищая стенки от чрезмерного нагрева. Синтез аммиака представляет собой экзотермическую реакцию, теплоту газа, выходящего из колонны синтеза с помощью теплообменника (цвет. Используя рисунок II), нагревают смесь азота и водорода до 400-500°С. Таким образом, реализуется принцип теплопередачи(I, стр. 167 и 170).
- В указанных синтетических условиях (400-500°С и давление 30 МПа), при равновесии, объемная доля аммиака, которая фактически образуется, составляет только 0.1-0.4.So, смесь охлаждают, аммиак разжижают, а непрореагировавшие азот и водород снова направляют в колонну синтеза(цвет. Рисунок II).Такой процесс, при котором непрореагировавшие вещества отделяются от продуктов реакции и возвращаются в реактор, называется циркуляционным. В лаборатории аммиак получают нагреванием смеси соли аммония и щелочи.
Тщательно перемешайте эти вещества, положите их в колбу и нагрейте (рис. 91): 2nh4c1 + Ca (OH) 2 CaC12 + 2H3Nt + 2h20 физические свойства. Аммиак-бесцветный газ, имеет характерный резкий запах, почти в 2 раза легче воздуха и очень хорошо растворяется в воде (в нормальных условиях около 700 объемов аммиака растворяется в 1 объеме воды, рис.92).
Чаще всего для этих целей используют хлорид аммония NH4Cl и (в избытке) гашеную известь. Людмила Фирмаль
С этим С самой последней установкой, более низкое давление использовано. Можно проверить проверенный опыт изучения физических свойств хлористого водорода (то есть 144). При высоком давлении аммиак сжижается. Жидкий аммиак вызывает сильное охлаждение при испарении: температура может быть ниже −30°C Химическое свойство. Аммиак является активным веществом substance.
In в реакциях с участием аммиака изменяется степень окисления азота или образуется особый тип ковалентной связи (табл.46). Когда аммиак растворен в воде, аммиачная вода formed. In этот процесс, небольшая часть молекулы реагирует с water. As в результате образуются ионы аммония NH4 и гидроксидные ионы OH.
Механизм образования ионов аммония аналогичен образованию гидроксон-ионов H30 +(p. одиночная пара атомов азота аммиака и водорода входит в свободную орбиталь Иона 4 с водородом Ковалентная связь по донорно-акцепторному механизму. Этот процесс можно схематически представить следующим образом. Диаграмма 91.Возьми аммиак.
Диаграмма 92.Растворение аммиака в воде. Н Я н-н-ч и н Родственные реакции это сопровождается изменением степени окисления азота с образованием ковалентных связей по лойор-акцепторному механизму. 1.Аммиак-слабое соединение n разлагается при нагревании: I −3.0 0 2HsN ^ N24 3H2 2.Аммиак горит с кислородом:4H, N + 30 — » — 2N2t + 6H20 2N-6e — * — N2 2 02+4ё — > 20 3 3 3.In в присутствии катализатора (сплава платины и родия) аммиак окисляется кислородом в атмосфере с образованием оксида азота (II). j o j 4II3N4-502 ^ — ^ 4NO-f6H20-3 +2 N 4 62 +4ё — #-20 5 1.
Аммиак реагирует с водой: n-n: n:+и n]♦^ n + he «или♦hjN♦hjo ^ Nh ^ + OH» 2.Аммиак реагирует с кислотами, так как ионы H +в молекуле более подвижны, чем молекулы воды. HSN + HCI — * nh4ci хлорид аммония аммиак реагирует с многоосновной кислотой 2 способами: 1j3n + H2S04- * — nh4iis04 сульфат аммония 211SN + 1104 (NH4)2s04 сульфат аммония Стрелки не указывают на сдвиг электронной пары к атому водорода, а лишь указывают на то, что он является донором общей электронной пары, к которой присоединяется атом азота.
В ионах аммония 4-я связь окрашивается таким же образом, поскольку она ничем не отличается от других 3-х связей. Н-Н-Н-Н Четыре * Дж.- н В структурной формуле аммиака и ионов аммония степень окисления азота одинакова, то есть −3.Однако, поскольку донорно-акцепторные связи являются типом ковалентной связи, ковалентными связями являются азот в молекуле аммиака 3 и Ион аммония 4. Приложение.
Аммиак необходим для производства азотной кислоты и азота fertilizers. It применяется также для производства аммиачной воды (водного раствора аммиака) и в качестве сельскохозяйственного (удобрения), применяемого в медицине и быту. Небольшое количество аммиака Рисунок 93.Применение аммиака и аммонийных солей: — 8. 10. Второй-получение минеральных удобрений. 5-для пайки. б-введение препарата; 7-вещества, используемые в повседневной жизни. 9-взрывчатые вещества; 12-азотная кислота.
Аммиачная вода называется гидроксидом аммония, потому что она не только реагирует с водой, чтобы раствориться, это аммиак в повседневной жизни. Аммиачная вода является слабощелочной, так как при взаимодействии аммиака с водой образуются аммиачные ионы NH /и гидроксидные ионы OH. См. рисунок 93 для получения информации об использовании аммиака. Вопрос 7-12 (стр. 49) и вопрос 1 (стр. 50).
Смотрите также:
| Положение элементов подгруппы азота в периодической системе, строение их атомов | Соли аммония |
| Азот. Физические и химические свойства азота | Азотная кислота |
