Оглавление:



Энергия системы из двух молекул
Энергия системы из двух молекул. При рассмотрении системы из 2 взаимодействующих молекул мы обычно думаем не о зависимости взаимного отталкивания от расстояния между молекулами, а о зависимости потенциальной энергии системы Е от расстояния r между молекулами. Если энергия E зависит только от расстояния между молекулами, то величина силы взаимодействия рассматриваемых 2 молекул равна eE / n. В качестве примера рассмотрим силу взаимодействия 2 реальных молекул газа, известную как сила Ван-дер-Ваальса (сила отталкивания, действующая на близком расстоянии около 10-8 см и притяжения, действующая на большом расстоянии).
Величина энергии расположения соответствует определенному расстоянию между молекулами. Людмила Фирмаль
- Эти силы проявляются как действие электрических сил. Если рассматриваемая молекула имеет дипольный момент (кейс); диполь), то за счет квантово-механического эффекта, вызванного взаимодействием движущихся электронов (Лондон), образуется индуцированный дипольный момент (Дебай) и взаимное притяжение молекул (в том числе и тех, которые не являются). Энергия системы из 2 молекул, сумма потенциальных энергий, возникающих в результате действия 3 типов гравитационных сил, описанных выше, может быть выражена следующим уравнением: ^ nR—0 * 26) Где с-величина, зависящая от величины дипольного момента и поляризуемости молекулы.
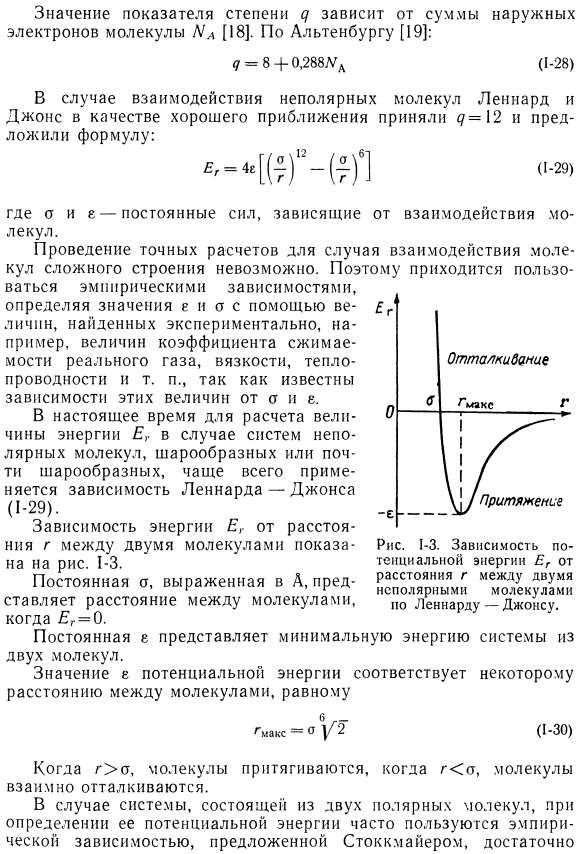
- Если расстояние между молекулами невелико, возникает взаимное отталкивание молекул. Потенциальную энергию отталкивания (Un) можно определить по следующей формуле: *В своем дальнейшем обсуждении автор в основном использовал данные из работ Барда, гюнцфельдера и Кертиса[9], а также данные вучкова и Новикова[17]. Величина индекса<7 зависит от суммы внешних электронов молекулы NA[18]. Согласно Альтенбургу[19]: <7 = 8 + 0.288 / ^(1-28) В случае неполярных молекулярных взаимодействий Леонард и Джонс взяли < 7 = 12 в качестве подходящего приближения и предложили формулу. ^ Ктг-Максимыч (, −29) Где А и Е-константы сил, зависящих от взаимодействия молекул. Точные расчеты в случае взаимодействия молекул сложной структуры невозможны.
Поэтому следует использовать эмпирические зависимости и определять значения e и ac, используя значения, найденные экспериментально, например, коэффициент сжимаемости реального газа, вязкость, теплопроводность и так далее. В настоящее время зависимость Леннарда-Джонса чаще всего используется для расчета величины энергии er в случае системы неполярных молекул сферической или почти сферической формы (1-29). На рисунке показана зависимость энергии ER от расстояния r между 2 молекулами. 1-3. Константа a, представленная A, представляет собой расстояние между молекулами при г = 0.
В последнем случае формула дает результат столь же точный, как и более сложное уравнение. Людмила Фирмаль
- Константы E представляет собой минимальную энергию системы из 2 молекул. gmax = o | / » 2(1 * 30) если r> 0, молекула притягивается, а если r <a, то молекулы отталкиваются друг от друга. В случае системы, состоящей из 2 полярных молекул, эмпирическая зависимость, предложенная Стокмейером, часто используется для определения ее потенциальной энергии. Точное число систем простых полярных молекул: ВГ е» е.Ф, Ф,=4Å [( * ) «т)6]“■7 * {(0″°r ‘ф> ф’>(1 ′ 31) /(0 |.02, Ф|)= 2С050, С0502-51П0 / ч! II-02 cos (F2-F]) (1 * 32) Где P-дипольный момент. 0/, 02, (Ф2—Ф1) угол ориентации диполя системы. Использование Формулы(1-31) затруднено. Точность расчета полярного газа приближается к точности расчета неполярного газа по формуле (1-29) [20].
Смотрите также:
Возможно эти страницы вам будут полезны:
