Электролиз расплавов
При электролизе электрод, соединенный с отрицательным полюсом источника тока, называется катодом; электрод, соединенный с положительным полюсом источника тока — анодом. На аноде всегда происходит процесс окисления, а на катоде — процесс восстановления.
Если графитовые электроды опустить в расплав соли 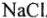 то при соединении с источником постоянного электрического тока положительно заряженные ионы натрия будут притягиваться к отрицательному электроду (катоду). При контакте с электродом ион натрия присоединяет электрон и превращается в электронейтральный атом натрия:
то при соединении с источником постоянного электрического тока положительно заряженные ионы натрия будут притягиваться к отрицательному электроду (катоду). При контакте с электродом ион натрия присоединяет электрон и превращается в электронейтральный атом натрия: 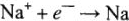 на катоде.
на катоде.
В это же время ион хлора притягивается к положительному электроду (аноду). На поверхности анода ион хлора разряжается, отдавая свой электрон: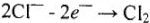 на аноде.
на аноде.
Расплавы солей широко используются для получения чистых активных металлов: 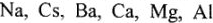 и чистых тугоплавких металлов:
и чистых тугоплавких металлов: 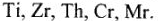
Алгоритм составления схем расплавов соли
1. Записываем диссоциацию расплава соли:
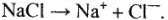
2. Указываем направление движения ионов в электролизере:
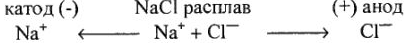
3. Приводим уравнение электродных реакций, протекающих на катоде и аноде:
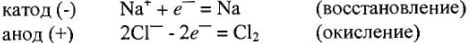
4. Составляем итоговое уравнение электролиза, суммируя электродные уравнения:
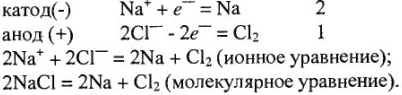
Эта теория взята со страницы подробного решения задач по всем темам химии:
Возможно эти страницы вам помогут:
