Оглавление:






Электронная структура некоторых молекул
- Электронная структура некоторых молекул Рассмотрим возникновение связей, используя метод МО Некоторые гомоядерные молекулы, образованные первыми 10 элями Цикл системы коп. Молекул Ng из воды Два атома водорода, каждый | 5 е отражают следующую запись. H [b ‘] + H [1 5] -. H, [(o, 15) ‘]. Два электрона молекулы ртути занимают один моль связи Орбита сформирована из 15 атомных орбиталей.
- Наличие двух электронов на одной молекулярной орбитали. Запись H2 [(o’I5) ^] отражается в верхнем индексе. Молекула нг Стабильный, потому что оба электрона занимают только связи ^ Имеет орбиту, энергия которой меньше энергии орбиты Порядок связи для каждого атома равен 1. Во взаимодействии Два атома, гелий, каждый из которых содержит два ls электронов Лорна, в МО нужно поместить четыре электрона.
База По принципу Паули о соединительной дорожке. Людмила Фирмаль
Поскольку он подходит только для двух электронов, остальные два электрона Энергия молекулы Heg находится в МО, а ее энергия Больше энергии Is-AO. Согласно формуле (А.4) Предположим, что порядок связи равен нулю, то есть химическая связь Это не происходит, и молекула не может быть стабилизирована. По словам Молекулярные молекулы достаточно устойчивы к методу М О.
Образование частиц H ^ из ионов H ^ и атомов водорода Hei H, Есть один электрон и ион водорода H ‘*’ ‘ Удержание электрона может быть представлено записью H (] s]! In, ls) J Эта запись показывает, что одна связь образуется из \ s-kO M O, порядок связи ‘/ 2- Молекулярный ион H t был обнаружен экспериментально. длина Связь этого иона составляет 0.106 нм.
Энергия связи составляет 277 кДж / моль. Uwe Увеличение длины связи и уменьшение энергии связи частиц По сравнению с длиной H ^ (0,074 нм) и энергией связи Молекула H 2 (436 кДж / моль) из-за уменьшения Порядок связывания от 1 до ‘/ г с учетом образования частиц Не из атомов гелия и ионов гелия, содержащих два 1 с электронов, Содержит один электрон: Он + он + _H эй В этом случае в МО необходимо поместить три электрона, два из которых.
Заполните связующее Os-MO, и третье связующее будет помещено сразу ^ Ослабьте M O (в зависимости от многих уровней энергии М О). Следовательно, частица He ^ «будет иметь электроны Структура; Neg ^ [(Osls) ^ (o jls) j. Порядок связи молекулярного иона равен 2, Пожалуйста, будьте достаточно стабильны. Экспериментально доказано Формирование этого иона. Рассмотрим заполнение М 2 О на примере молекулярного кислорода O 2 образуется из атомов, содержащих два.
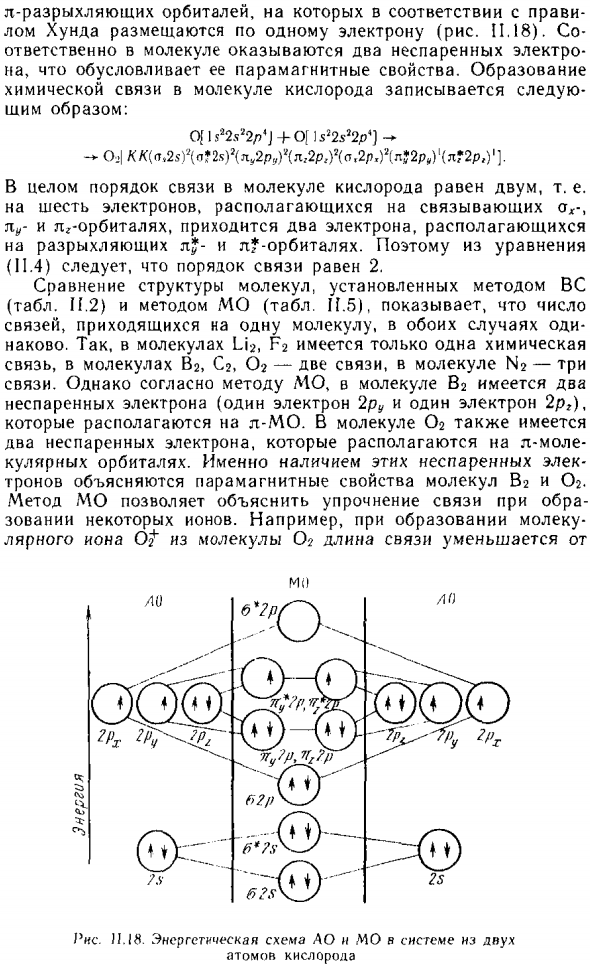
Трон, два 25 электронов каждый и четыре 2р электронов, электроны Состав ls ^ 2s ^ 2p ^ Первая энергия атомной орбитали Формы нижнего уровня МО (aJls) ^ и (a * ls) ^, создают скелет Молекула. Эти заполненные МО обозначены буквой К. S-электроны на втором энергетическом уровне движутся от АО На M O один остается связанным, и один f-кратный образуется. Ослабьте траекторию. Вторая энергия р-электрон Уровень (в порядке увеличения энергии связи).
- Переход от 3 AO rx, Ru, rg к M O, 1 ОГ в сочетании МО AO px, формирование двух L-связанных МО. В то время Четыре электрона расположены в A 0 (pu и pg), образуя два электрона свободная орбита, согласно правилам на ней Каждый лом Хунда помещается на один электрон (рис. 11.18). и В молекуле два неспаренных электрона ответственны определить парамагнитные свойства. образование.
Химическая связь молекулы кислорода записывается как Следующим образом: 0 [1 с ^ 2 с’2 / 7 ^ J + 01 1 с ^ 2 с ^ 2р ‘] — * 021KK (n, 25) \ a * 2πY (n, 2p, ((n: 2p, Y (a, 2p, ^ (n * 2p,} ‘(l2p, Y]). Обычно порядок молекулярных связей кислорода равен двум. К шести электронам в связи о ^ — Есть два электрона,% — и l орбитали Loose и L? — орбита. Так из уравнения (11.4) Порядок связи — 2.
Сравнение молекулярных структур, установленных методом BC (Вкладка I, 2) и метод МО (вкладка I.5) Связи на молекулу, оба Nakobo. Людмила Фирмаль
Следовательно, молекулы L12, Pr имеют только одно химическое вещество Bond, B 2, C 2, O 2 внутримолекулярные-2 связи, N 2 внутримолекулярные -3 Связь. Однако по методу МО, Неспаренные электроны (1 электрон 2р1 ^ и 1 электрон 2рг), в л-мес. О, у меня тоже есть молекулы Два неспаренных электрона в L моль Orbital. Это наличие этого непарного электричества тронов объясняет парамагнитные свойства молекул Br и O 2.
Метод МО может объяснить укрепление связи. Образование специфических ионов. Например, когда образуется молекула Длина связи иона O ^ от молекулы O М; 1 0,121 ~ 0,112 нм, энергия связи от 494 629 кДж / моль Укрепление связи путем удаления электричества L * Свободная орбита и соответственно больший трон Порядок связи от 2 до 2,5. Энергия связи молекул Ион F т (318 кДж / моль) Молекула Pg (159 кДж / моль). Объясните увеличение энергии связи Это удалено, удаляя электроны от свободной α-орбиты. Увеличьте порядок связи с 1 до 1,5.
Данные по энергии связи молекулярных ионов следующие. Четкое подтверждение эффективности метода МО. Метод МО Гетероядерные двухъядерные и многоядерные структуры можно рассматривать Атомная молекула. Например, образование молекул СО Присутствует на рисунке C [15 ^ 2.9 ^ 2p ^] + 0 [15 ^ 25 ^ 1 ^ CO [KK (as2s) \ of2s) ^ a2p.nly. , 2р ,,. N О молекуле азота, МО внешней энергии Уровень молекул СО составляет W электронов.
8 электронов в сочетании с МО, 2 электрона в сочетании с провисанием Порядок связывания СО, как у молекулы M.O.N2, Это приносит сходство со свойствами азота и оксидов. Углерод: длина связи O, PO и 0,113 нм, энергия связи 940 и 1040 кДж / моль, точки плавления 63 и 66 К соответственно Конечно Таблица II. 5. Ядерная электронная конфигурация и параметры связи Двухатомные молекулы и ионы методом МО и, следовательно, с использованием молекулярно-орбитального метода.
Может хорошо объяснить характеристики различных молекул. Таким образом Важное значение при предоставлении данных о свойствах молекул На основании характеристик соответствующего атома. Метод МО Не исключает метод валентной связи, оба метода взаимно Дополните друг друга. В общем, оба метода (и БК, и МО) работают Квантово-механическое обоснование и дальнейшее развитие Теория химического строения А. М. Бутлерова.
Смотрите также:
| Полярные и неполярные молекулы | Взаимодействие между молекулами |
| Метод молекулярных орбиталей | Вандерваальсовы силы |
Если вам потребуется помощь по химии вы всегда можете написать мне в whatsapp.
