Оглавление:





Метод молекулярных орбиталей
- Молекулярно-орбитальный метод BC метод обеспечивает теоретическое обоснование для многих структур Предсказать молекулы и их свойства. По словам В до н.э химические связи формируются для социализации Пара электронов, то есть пара электронов, каждый Два взаимодействующих атома дают один электрон Рон.
- Так на солнце метод, Молекулярный ион H ^; имеет только одну связь. Существование живых электронов и свободных радикалов, То есть он содержит неспаренные электроны, Высокая реактивность. Это не описано в методе BC. Тот факт, что связь усиливается, когда электроны отделены от некоторых Например, молекулы из Pr молекул. Этот метод не может объяснить пар. Магнитные свойства молекул Og и Br.
Уникальный магнитный Момент молекулы (парамагнетизм) Поврежденный электрон. Людмила Фирмаль
По методу БК молекулы Og и Br Не имеют неспаренных электронов, то есть они должны быть Магнитный (не имеет собственного магнитного момента). Молекулярные методы оказались более общими и универсальными. Орбита (M O), которая может объяснить факты Я не могу понять с позиции солнечного метода. Метод М О является естественным распределением Теория атомных орбиталей (АО) о поведении мо электронов Rukyure.
Предполагается, что электроны в молекуле находятся на Молекулярные орбитали, охватывающие все ядра Мо lecule и M O занимают весь объем молекулы. Вот так Метод М О учитывает множество молекул и других стабильных факторов Атомная система как «многоатомный атом», где существуют электроны Он находится на орбите, называемой молекулой.
Так Как электрическое поле влияет на молекулярные орбитальные электроны Образование М О из многих ядер, АО, приводит к уменьшению Системная энергия. Представьте, что атом А свободен Или подойти к паре электронов, атом B. Система атома два в лиробанике Ядра а и б. Поле имеет электроны для этих атомов.
Когда молекула состоит из n атомов, а общее число rons / V, молекулярные состояния могут быть представлены системой n Центр силы, когда есть N электронов. такой Молекулярные идеи как взаимодействующие команды Все ядра и электроны являются основой теории МО метода. Ключевой момент Каждый электрон в молекуле специфичен Уровень энергии характеризуется Воющий квантовое число.
Энергетический уровень соответствует МО или волновой функции Это многоядерная страна. Общее количество изображений Взаимодействие МО равно общему количеству взаимодействий АО; -Молекулярные волновые функции одинаковы физические То есть атомная волновая функция t, то есть Плотность вероятности электронов Элемент объема пространства.
К -Средняя энергия МО, полученная из АО, практически одинакова Дайте эти АО как среднюю энергию. Но немного энергии рё МО ниже энергии исходного АО Наоборот, время энергии других МО больше, чем результат энергии Нью-Йорк АО; -Пакетный уровень энергии электронов в молекуле происходит в порядке возрастания энергии. Более высокий уровень; — По пудингу, в одном энергетическом состоянии Чип Паули может иметь не более двух электронов.
В большинстве случаев метод М О называется расчетом Линейная комбинация АО или опущена L K A O (всего) Инициалы этих слов). Когда показана волновая функция изолированного атома А через grA, через волновую функцию атома B 1) Метод МО, молекулярная волновая функция линейна Комбинация атомных волновых функций. Где С |, Сг — фактор, учитывающий участие атомов Орбиты атомов A и B при образовании молекулярных орбиталей.
Добавление двух АО, которое является выражением МО, Электроны в молекуле покрывают оба ядра (т.е. взаимодействие В обоих ядрах). Такое МО В о. Кроме того, оба электрона Большую часть времени проводят между двумя ядрами. Способствует связыванию атомов. Этот МО называется с I Имя (рисунок [(, 14). Его волновая функция уравнение Вычитание атомной орбитальной функции образует моль.
- Орбита, область разреза направлена В направлении, отличном от атомов. Следовательно, между атомами Плотность электронов равна нулю, а ядро отталкивается Отделены друг от друга. Такие молекулярные орбитали Продлен или против старения. молекула Траектория обозначена индексом АО и сформирована из него Кроме того, растворение, которое ослабляет МО, обозначено звездочкой.
Следовательно, а указывает, что МО образует d-связь. От 5-го АО и до ^ , / C l e и C b ЮО ^ ОЭС 5-АО. Форма молекулярных орбиталей примерно Существует на основе оригинальной формы атомных орбиталей. Может также образовывать молекулярные орбитали из АО Энергетическая диаграмма показана (Рисунок 11.15). горизонт Общая линия в конце рисунка соответствует энергии.
Для каждого АО отдельных атомов и средней энергии Связывание и релаксация молекулярных орбиталей. Людмила Фирмаль
Связанные и расслабленные M O электроны Неблагоприятное влияние на молекулярную стабильность: каждый Компенсация за одну занятую привязку путем ослабления траектории Orbit. Поэтому порядок связи в методе МО (кратность) Определяется разницей в количестве электронов в связи, Ослабьте траекторию. Как солнечный путь.
Две привязки Электроны соответствуют простым связям, четыре связи Электрон-двойная связь и др. Количество связующих, количество рыхлостей Электронный электронный ,,, Порядок связи = ^ ————— (1.1.4) В методе MO порядок связи играет ту же роль, что и следующая. BC метод валентности. В отличие от метода БК метода МО Согласитесь, что коммуникационное образование не всегда необходимо Поскольку это пара электронов, этот метод позволяет упорядочить.
Присоединение равно ‘/ 2. ^ / 2 и ^ / 2. Чтобы сформировать МО из АО, Должны соблюдаться следующие условия: близко к) Начальная энергия АО. б) Значительное дублирование АО. в) Одинаковая симметрия АО относительно оси молекулы (выше Пример p-AO может взаимодействовать с p-AO, но не в комбинации с ru-AO или rg-AO). Атомные орбитали могут взаимодействовать друг с другом M O образуется в a-типе, l-типе и th-типе.
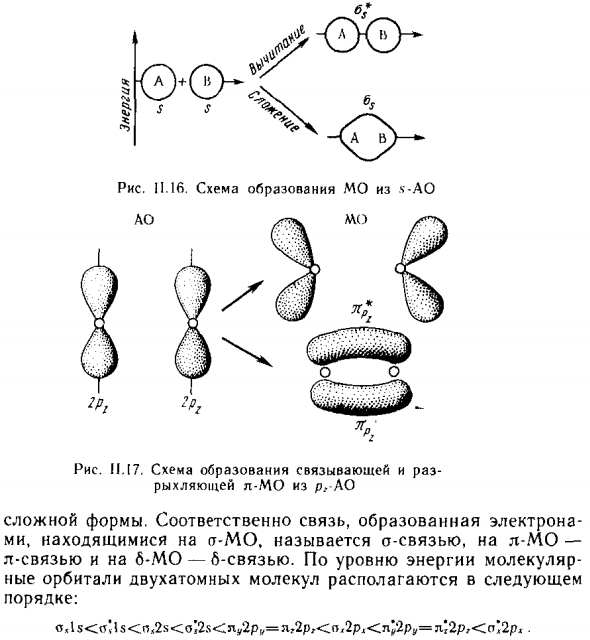
Может комбинация по типу 5-, р- и ¿ -Ao. Сформированные молекулярные орбитали На рисунке показан 5-АО. С.16. Сочетание двух пх-АО Происходит для каждого типа. В этом случае один обязательный ^ -MO и ^ -Mb ослабление (рис. 1.14), вместе Два акционерных общества 6 Появляется в виде с образованием ^ / ^ / МО и * ^ -МО комплексы / \ Форма. / \ L тип, взаимодействие р- и ¿ -АО только.
В сочетании \ / 2 ruA 0, 1 соединение происходит Позвоните \ / d ^ -MO и один слабый ^ Я я ^ -MO, а также ^ 5 Применяется комбинация pr-AO (Рисунок 11.17). L-тип также может взаимодействовать Рис II 15, некоторые из них по силовой схеме -КО. О Р6 AO и MO двух систем могут перекрываться только с частью. Образование атома водорода ry — AO и B-MO Рисунок 11.16.
Схема для формирования МО из .ч-АО АО Рисунок 11.17. Склеивание и Ослабьте L-MO от R / -AO Сложные формы. Таким образом, связи, образованные электронами mi в a-MO является a-связью, в l-MO- 1-связь и В-МО-В-связь. По уровню молекулярной энергии Двухатомные молекулярные орбитали находятся на Заказ: o, 15 <o’15 <n, 28 <o12x <Lu2p „= l, 2p ;. <n, 2p ^ <l ^ 2pu = d’2rg <o * 2
Смотрите также:
| Пространственная конфигурация молекул | Электронная структура некоторых молекул |
| Полярные и неполярные молекулы | Взаимодействие между молекулами |
Если вам потребуется помощь по химии вы всегда можете написать мне в whatsapp.
