Оглавление:


Пространственная конфигурация молекул
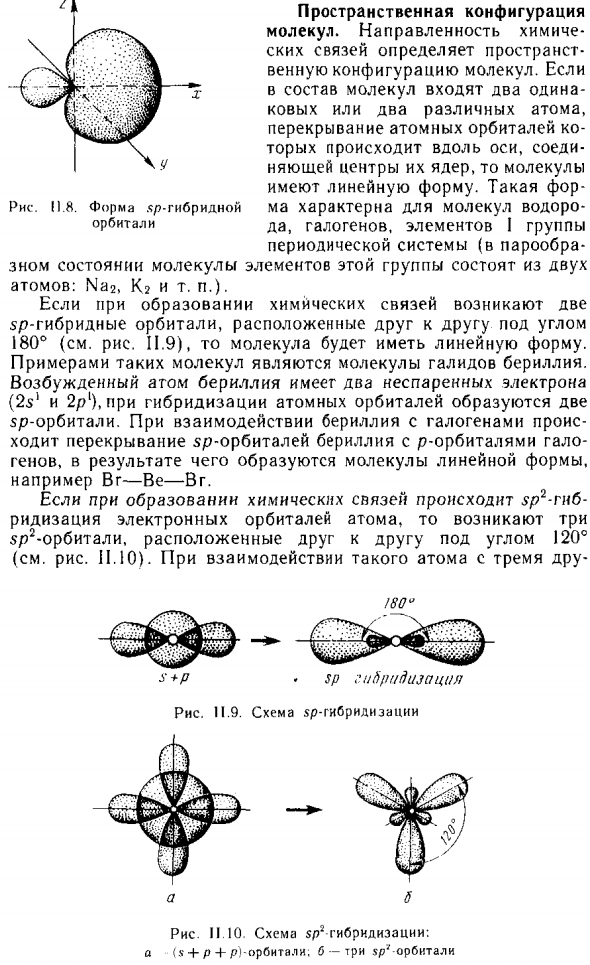
- Пространственная композиция Молекула. Химическая ориентация пространство Молекулярное расположение. если Молекула содержит два озина Два или два разных атома, Перекрывающиеся атомные орбитали Происходит вдоль оси Ядерный центр мерцания, затем молекула Он имеет линейную форму.
- Такой гандикап МА является особенностью молекулы водорода. Да, галоген, элементы I группы Периодическая система (в паре Зная состояние, молекула этой группы элементов состоит из двух Атом: Наг, К2 и т. Д.). При образовании химических связей 2 Sp гибридные орбиты расположены под углом друг к другу При 180 ° (см. Рис. 11.9) числитель является линейным.
Примером такой молекулы является молекула галогенида бериллия. Людмила Фирмаль
Возбужденный атом бериллия имеет два неспаренных электрона (2 с и 2 р), 2 при атомно-орбитальной гибридизации sp орбита. Когда бериллий реагирует с галогенами, Перекрытие бериллиевой sp-орбиты и гало-p-орбиты Гены, которые приводят к образованию линейных молекул, Например, Br — Be — Br. Если íp ^ -изгиб происходит во время образования химической связи.
Если электронная орбита атома рандомизирована, 3 5p ^ -битов в позициях 120 друг к другу (См. Рисунок 11.10). Взаимодействие таких атомов с остальными тремя атомами ¡ 80 ‘^ ^ + P • с п г и б р и д и г и т и я Рисунок 11.9. Схема гибридизации SP Рисунок 11.10, схема гибридизации sp ^; (S -1-p + p) -орбиталь; b-3 sp ^ -орбитали Рисунок 11.11. Схема $ p ^ -гибридизации: a- (5- | -p + p + p) -орбитали; 6-4 5p ^ -орбиталей.
Молекула, образованная в форме плоского треугольника Ка, например, молекула BPz: Fv f «J 120» Во время 5p ^ гибридизации образуются четыре 5p ^ -орбитали, Они уложены вместе под углом 109 ° 28 ‘(см. Рис. 11.11). Поэтому при взаимодействии с атомами 1 5 и 3 р электронов, 4 других атома Формируется молекула с тетраэдрической структурой. о странное расположение молекул, образованных между И 5p ^ гибридизация показана на рисунке. 11.12, а, б, в и Приведено в таблице. 11.3.
- Другие типы форматов гибридизации Более сложные молекулы (рис. \ L2, d, e; Tab. II.3). Таблица 11.3. Пространственная структура некоторых соединений Соединение Чис фильтрат Electrabel трон Нью-Йорк пар Гибб леди народ Orbiviruses подъемный механизм цент Лар многие атом или Угол молекулярного состава соединение Мультипликационный персонаж COi, HgCb, BeFs 2 sp linear 180 Vre, BCLi 3 <Треугольник, квартира 120 N H 3 3 зр.
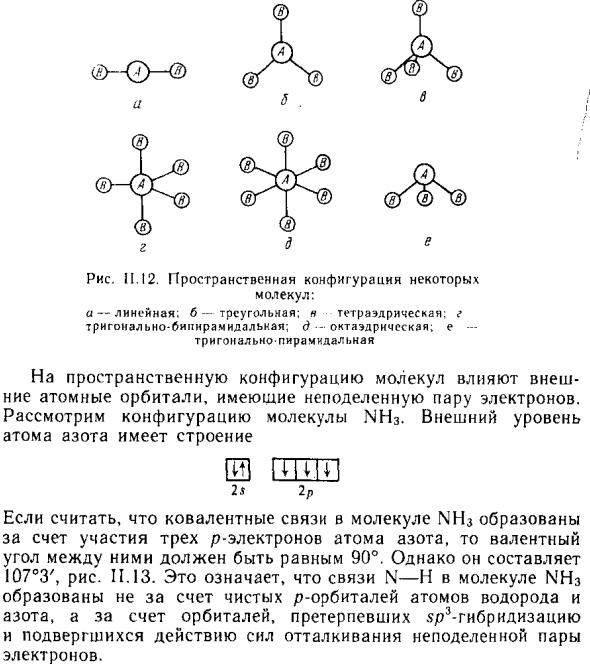
Треугольник, пирамида 107,3 CH ^. SiH. 4 с р \ тетраэдр 109,28 P C 15 5 dsp ‘треугольная, двойная пирамида 90 с F «6 октаэдр 90 (^ — © — Рисунок 11.12. Некоторые пространственные конфигурации Молекула: Но линейный, b-треугольник, тетраэдр, е Треугольный бипирамидальный; d — октаэдр. e- Треугольная пирамида На пространственное расположение молекул влияет внешнее.
Атомная орбиталь с неразделенной парой электронов. Людмила Фирмаль
Рассмотрим расположение молекул Ln3. Внешний уровень Атом азота имеет структуру И пттт 2s 2p Предполагая, что ковалентные связи молекул LNC образуются Валентность обусловлена участием трех р-электронов атома азота Угол между ними должен быть равен 90 °, но это 107 ° 3 ‘, рисунок 11.13. Это означает связь N-H молекулы Ln3 Не чистыми p-орбиталями атомов водорода, Азот и орбитали, проходящие р-гибридизацию Сила отталкивания выставленной пары E.
Смотрите также:
| Ϭ-, π- и ẟ-Связи | Полярные и неполярные молекулы |
| Гибридизация атомных орбиталей | Метод молекулярных орбиталей |
Если вам потребуется помощь по химии вы всегда можете написать мне в whatsapp.
