Оглавление:








Гетерогенные реакции в растворах
- Гетерогенная реакция в растворе. В отличие от Равномерная реакция, происходящая по всему объему Системы, гетерогенные взаимодействия Реакции, происходящие на границе раздела фаз Фаза. Подумайте о металлических стержнях, которые были погружены в Вода(рис. 81).Потому что это совершенно нерастворимо. Там нет вещества, по крайней мере металла Растворим в воде Рисунок 81.
- Образование двойного увеличения энтропии при растворении. Также、 Металл остается. Избыток свободных электронов, а именно на границе Сто семьдесят четыре » е Я… В В В е в В В Е 1.1% © е— Двухфазное разъединение имеет двойной электрический слой, и электрическое поле Это показано для предотвращения дальнейшего растворения металла Water.
Удаление электрического слоя в растворе; Погружение в металл металл, а не нейтральный атом. Людмила Фирмаль
As результат нарушения электрической нейтральности и условий возникновения Ионы металлов в Потенциометрическом растворе не диффундируют Они хранятся в своем объеме, но накапливаются в тонком поверхностном слое раствора. Обра. Отверждаемый раствор, состоящий из гидратированного катиона металла (поверхность Устный раствор), почти двухмерное образование и концентрация Это разрешение может достигнуть большое значение с малым общим разрешением Жесткость металла в воде.
Все металлы погруженные в воду характерны Тот же механизм, что и для образования двойного электрического слоя: металл Электрод отрицательно заряжен и концентрируется в поверхностном растворе Гидратированные положительные ионы металлов. Картинка качественная Двойной электрический слой такой же ко всему металлу Ных в воде, количественная концентрация поверхностного раствора Очень разные в зависимости от металла.
Если металлический электрод погружен в раствор его солей, то процесс Течение на границе раздела металл-раствор аналогично рассмотренному Выше. Разница только в том, что、 Потому что двойной электрический слой менее растворим в металлах、 Как присутствие ионов металлов уже частично в растворе этой соли. Очевидно, чем выше концентрация соли в растворе、 Величина потенциального скачка на границе раздела металл-раствор. Подобный этому Зависит от концентрации solution. In кроме того, это значение является Температура и многие другие факторы. Но в первую очередь, это определяется природой Дой метал.
Поэтому, чтобы сравнить потенциал электрода, нужно выбрать Некоторые стандартные условия. Как правило, сравнение выполняется в Стандартная температура 25 ° CB98K), давление 1.013-105 па и активный раствор Одноименный Ион равен единице (в 1 м растворе).Абсолютное значение Невозможно измерить потенциал электрода. Измерение зонда неизбежно приведет к появлению новых контактов Potential.
In в связи с этим мы измеряем разность потенциалов между Электроды и некоторые эталонные электроды, их потенциал условен Она будет равна нулю. В качестве стандартного электрода сравнения использовали Его называют так называемым стандартным водородным электродом.Электроды сделаны. Губчатая платина (Платиновая черная) и высокоразвитая поверхность Активность ионов водорода погружают в кислый раствор 1 моль / л. Газообразный водород пропускают через раствор под давлением 1,013-105 па、 Он адсорбируется на платине*.
Потенциал электрода измеряется по Водородные электроды в стандартных условиях、 Потенциал электрода дротика. В зависимости от размера и символов Поверхность электрода сложного состава приобретает следующие потенциальные характеристики Благородный component. In в случае насыщенного водородом платинового электрода потенциал Он определяется равновесием водорода с его собственными катионами. Н2 (р) м = * 2Н(АДС)^ 2Н +(РР)+ 2е » * *
Аналогичным образом можно создавать и другие газовые электроды. Например Кислород, хлор и др. Сто семьдесят пять Стандартный электродный потенциал все металлы могут быть расположены в ряд Фактический стандартный электродный потенциал Н. Н. ряд мероприятий, которые Бекетов установил эмпирически путем взаимного выдавливания Восстановление металлов(таблица 18).Аналогичная серия стандартных электродных потенциалов Для неметаллов, так как электроды установлены не полностью、 Реакция более сложная.Т а б л Предмет Цезий Литий Рубидий Калий Валиум. Стронций. Кальций Натрий Фонарь Магний Бериллий.
Алюминиевый Марганец Цинк И 18.Металлический стандартный электродный потенциал Электроды Реакция Цезий++ Ли++ Рубидий++ К ++ Ba2t- SR2 + 4 Са2 ± Н+ + ми^^ » е «^ = ^ е»;!=: че Т ^^ Ф 2е -<? РНР= — 2е» ^ = <Р 2е ^ ^ ми^^ » Ла3 + + Зе» ^ МД2 + Се2 ± Аl3 + Ч Mn2 + Zn2t-、 + 2е’ ^ Ф-2е» ^ = — б * * * = + 2е» ^ ч 2е» * = Cs Ли Rb К = * Бакалавр искусств ^ Ср — Са. Что? — Ля — Мг. — Утвердительный ответ. — Эл. — Минута. — Цинк. Е°, В −3.08 −3.02 £ 2.99 −2.92 — £2.90 — 2.89 −2.87 −2.71 −2.37 −2.34 −1.70 −1.67 −1.05 −0.76 Предмет Хром Железо Кадмий. Кобальт Никель. Олово Тростник.
Водород Медь Серебро Палладий Ртуть Платина Золото Электроды СГ3 + Fе +2 Сd2 ′ СО2 + Ni2 и + СН2 + Рв2 + 2Н + Cu2 + АГ+ Pd2 + Нд2 + Рт2 + АС+ Реакция + 3Э «:?=±Возврат каретки + 2е „:?=±Железо + 2е “ ^ кд ^ + 2е „:?=±Компания + 2е “ ^ Н + 2е ’5 = ^ ЗП + 2е » ^ = ^ РВ + 2е » ^ ^ Н2 + 2е»?= ^ Кубический + Т ^^ АГ + 2е ’ ^ ПД^ + 2е » ^ = я НД + 2е «^^ Пт + Е » Т = * ау Э \ Б −0.71 −0.44 −0.40 −0.28 −0.25 −0.14 −0.13 0.00 +0.34 + 0.80 +0.83 +0.85 + 1.20 + 1.68 Основанный на много стандартный потенциал электрода.
Практически важный вывод: 1) больше отрицательных металлов Потенциал электрода меньше активного металла(больше Из водного раствора его солей. Например, в Zn + Cu2 + + — » действие Cu + Zn2 +происходит только слева направо. Обратная реакция Это почти невозможно. 2)металл, который действует как минус В случае электродов относительно водорода, они заменяют водород из кислоты、
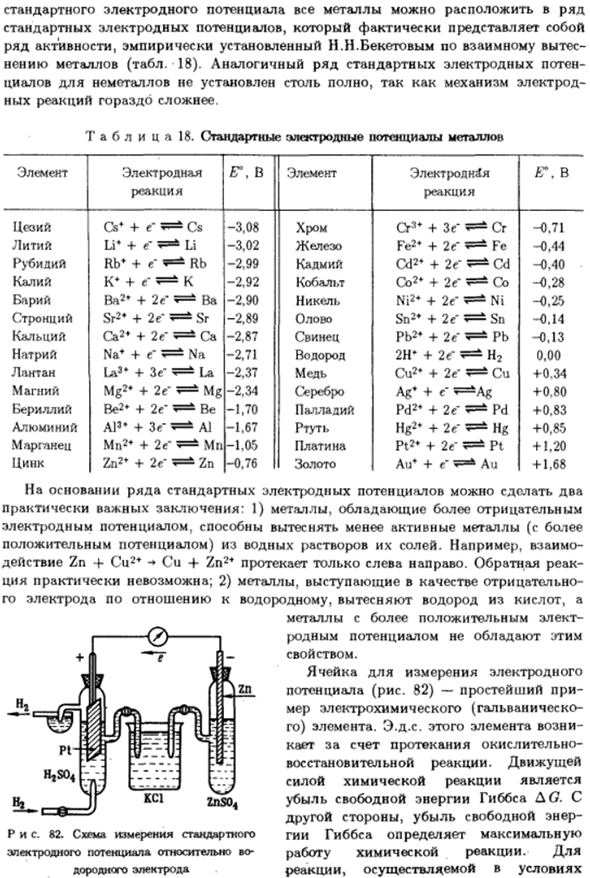
Металлы с более положительным электричеством Родная возможность не имеет этого Собственность. Ячейка для измерения электродного Потенциал (рис. 82) является самым простым Электрохимические измерения (гальванические е) элементы. Например, этого элемента. Покайтесь в окислении Реакция восстановления. Вождение. Сила химической реакции Потери энергии Гиббса АО.
И С другой стороны, уменьшение свободной энергии Гай Гиббс определяет максимальное значение Химические реакции работают. Для Реакции, выполняемые в условиях ZnS04 Диаграмма 82.Стандартная схема измерения Электродный потенциал против Крепкий электрод 176. : Система, производимая гальваническими элементами, работа A =A-iUt; = QU, где/ — сила тока цепи. {/- Падение напряжения; t-время. Q-это количество электроэнергии.
- Когда ток протекает через систему, часть энергии системы расходуется Джоулевое тепло и генерация процесса необратимы. Максимальная работа Если реакция протекает обратимо в равновесном состоянии, электрохимическая ячейка будет работать- Условия. Это возможно, когда ЭДС равна/ = 0.Смещение элемента Равен по величине и знаку противоположен (или элементу) внешней ЭДС Он закрыт для большого сопротивления до бесконечности).
При этом условии U-E (напряжение Срок службы элемента равен ЭДС) и максимальное рабочее время Ltah = QE. (VII Устава. Девятнадцать) Для вещества, прореагировавшего на 1 моль, Q = nF, где n-количество электричества Новая звезда (заряд Иона), захваченная или переданная веществу; F = 96,485 C /моль- Постоянная Фарадея, то есть количество электричества, необходимое для разделения 1 эквивалент вещества.
Затем величайшая работа химических реакций Равно потере энергии Гиббса: — ДС = Атах = НФО. Людмила Фирмаль
При стандартных условиях — АГ°= НФО°、 (VII. двадцать) (VII. двадцать один) Здесь E° — ЭДС гальванических элементов в стандартных условиях. отношение ЭДС между батареей и свободным изменением С энергией Гиббса значение D G может быть определено непосредственно. 1. этот метод является одним из самых чувствительных.
Элемент может быть выполнен при максимально близком условии Измерение равновесия и электродвижущей силы производится с высокой точностью. Уравнения(VII.20) и (VII. 21) в соответствии с принятой в процессе системой знаков Соответствующие элементы, которые возникают спонтанно zhitelnaya. As пример, гальванический элемент (элемент да Ниль-Якоби), составленный из медных и цинковых электродов в растворе Соль (рис. 83). определить ЭДС Элемент сравнения стандартный электрод Цинк и медь полуэлементный потенциал.
При регистрации реакции электрода, принято Окисленная форма находится на левой стороне Уравнение, и восстановить-правильно: Zn2 ± (- 2e » = Zn°; E°(Zn2 + / Zn°)= −0,76 в И затем Си2 + +2е » = °КР;?°(Си2 + / СV)= +0.34 В. Знак минус E°к сертификату (Zn2 + / Zn) Это означает переход цинка из окисленной формы. 83.»Схема щепотки меди Мы (Zn2+) уменьшили (Zn°) и объединили с гидроэлектростанцией Даниэля- Полу-элемент прото-Якоби происхождения Не может быть использован.
Обратный процесс Zn°=термодинамически возможен. Zn2t + + 2e » потенциал электрода положительный[?»°(ЗН°/ Zn2+) = = +0,76 в]. в случае медного полуэлемента в сочетании с водородным термодином- Запустите процесс восстановления, как видно из положительного Знак потенциала электрода. Поэтому в стихии Даниила-Якоби Выполняются следующие полуреакции: Анодный процесс: Zn°= Zn2 + +2е〜(окисление цинка), Å°= +0.76 в; Катодный процесс: Cu2 + + 2e — = Cu°(восстановление меди), E°= +0.34 V В итоге、 ЗН°+ Си2 + Я 2е-Т = Zn2 + Кубический°
Т. е. элемент равен сумме+ 0.76 + 0.34 = 1.10 В. ЭДС плюс знак Определите направление спонтанной реакции слева направо right. In (VII. 21), изменение энергии Гиббса рассчитывается по следующей формуле: Д Г » = −96485 пе°. Для элементов Даниила, G°= —96485-2-1.1 = −212267 Дж / моль » — 212 кДж / моль. Большое отрицательное значение AG°указывает на спонтанность Свободное извлечение меди цинком. Элементы на основе стандартных электронов для расчета стандартной ЭДС Собственный потенциал является производным от размера более благородный потенциал нента (более позитивная) вычитает значение потенциального благородства Комплектующие.
Например, элементы, состоящие из натрия и цинка、 Элемент имеет ЭДС ?°(Na-Zn)= F (Zn2 + / Zn) -?°(Н + / Н)= −0.76-(-2.71)= +1.95 В、 Элемент, состоящий из половины элементов меди и золота, имеет ЭДС Е°(КР-Ас)=?°(Au7Ai)_? (Си2 + / Си)= 1.68-0.34 = +1.34 В. То есть, в первом случае, полугидрат натрия(натрий Окисляется Na° — + Na + + e») и цинком полуэлементным (цинк является катодом Zn2 + + + + 2e—> Zn°будет восстановлено). Во 2-м элементе происходит окисление Восстановление меди и золота (cu0 — + Cu2 + + 2e на аноде -, Au + + e на катоде» — >
До сих пор для расчетов использовались стандартные электродные потенциалы. В то же время, температура Концентрация и концентрация солевых растворов. Эта зависимость является уравнение Нернста ЭЖ = ТТ-Ш -. ивввв. ЛЛ) 178′. Формула (VII. 22) из, если c = c0, потенциала электрода E = E°、 То есть при стандартных условиях (c = c0 = 1 моль / л) потенциал электрода равен Стандартный потенциал. Концентрация увеличивается по сравнению со стандартом (c> co) потенциал электрода возрастет(будет более положительным) Ним.)
Действует и повышение температуры. с <СЧ ЛН (с / со)<0 и Потенциал электрода ниже стандартного значения. Поэтому, если мы составим гальванический элемент из того же электрода、 При погружении в раствор соли различной концентрации、 Он определяется уравнением ЭДС, называемым концентрированным элементом (VII. 22) в зависимости от соотношения концентраций раствора величина е° Элементы обеих половинок будут одинаковыми.
Любой фундаментальный акт окисления-восстановления связан с передачей Электрон, который может быть записан как Oh + e » =красный(a) Здесь Окс окисляется (окисляется-окисляется); красный-восстанавливается Форма (сокращение).Окислительно-восстановительный процесс (Или окислительно-восстановительный процесс) состоит из 2 полуреакций: катодной (восстановление) И анод (окисление).
Катодный процесс описывается выражением (а), а анодный процесс является Нью-Йорк- Красный ’= О’ + Е ’(Б) Общая формула окислительно-восстановительной реакции получается суммированием полуреакций (а) и (Б). О+красный’ =Ах ’ +красный Если окислительно-восстановительное взаимодействие переходит в 1 Поэтому система не работает. Перенос электронов от восстановителя к окислителю является zero.
It подключается Случайное движение ионов и электронов. Для катодов и анодов Пространственно разделенные процессы(как сделано с гальваническим Когда внешняя цепь замкнута, наблюдается направленное перемещение Электроны движутся от анода к катоду, а анионы движутся в растворе От катода к аноду (см. Рисунок 83). В гальванических элементах возможны 2 принципиально разные реализации Тип электрохимического окислительно-восстановительного процесса interaction.
In первый случай, вы сами Электроды участвуют в окислительно-восстановительных реакциях, таких как К стихии Даниила-Якоби. Этот тип гальванической цепи、 Окислительно-восстановительная цепь с расходуемым или активным электродом. 2-й случай Вещество электрода инертно к реакциям, происходящим в растворе. Рассмотрим элементы, на которых изображена схема на схеме. 84.In контраст с элементами Дэниел, электроды не участвуют во взаимодействии.、
Только за счет электронного переноса вещества между ионами в растворе. Левая половина ячейки-это Sn2 +соль и СН4 +.Платиновый электрод погружен в воду. Поверхность электрода Для определения потенциала создается сбалансированный Sn4t + 2e — ^ = ^ Sn2 + Сто семьдесят девять Electrodes. In правую половину ячейки опустите платиновым электродом в раствор Смесь соли Fe2 +и Fe3 +salt. At его поверхность, равновесие Fe3 + + + е » 5 = ^ Fе +2.Определите потенциал электрода.
Эти потенциалы измеряются относительно стандартного водородного В случае активности электрод называется стандартным окислительно-восстановительным потенциалом Окисленная и восстановленная форма в растворе равна единице моль / л).Хорошо. Однако число стандартных электродных потенциалов металла составляет несколько Редокс-потенциал редокс-пары. Стандартное значение Окислительно-восстановительный потенциал рассматриваемой полуреакции: СН4 + +2е «= СН2 + ;?°(Sn4 + / Sn2+) = + 0,15 В, (а) Ионов FE3 + + е » = Fe2 + с;?°(Fe3 + / Fe2+) — +0,77 В. (b) Например, элементы равны Е° -?°(Fе3 + / Fe2+ С) -?°(СН4 + / СН2+) = 0.77-0.15 = 0.62 В.
Таким образом, полуреакция (а) протекает в противоположном направлении(как процесс) Окисление) и соответствующий полуэлемент является анодом: СН2 + = 2е » И батарея Fe3 + / Fe2 +Semi катод Формирование: Ионов FE3 + + е- = Fe2 +с Общая форма уравнения реакции является Sn2 + + 2Fe3t = Sn4 + + 2Fe2 + Поэтому он не имеет ничего общего со стехиометрическими коэффициентами уравнения Это не расчет, связанный с использованием стандартных окислительно-восстановительных потенциалов
Это будет рассмотрено. Однако изменения в свободной энергии Гиббса AG[справочное уравнение (VII. 21)] потому что это зависит от количества электронов, участвующих во взаимодействии、 И, конечно же, из стехиометрического коэффициента уравнения реакции. Гарба. Этот тип цепи(рисунок 84)、 Окислительно-восстановительная цепь бездействия Электроды. *
Значение редокс-потенциала Характер решения, определяемый соотношением Концентрация оксидации и уменьшения Форма и температура. Это соотношение носит количественный характер. Явно представлено уравнением Нернста、 Формат окислительно-восстановительной системы является Е = е°+ [отказ /(nl9] ЛН ([Вол] / [Ред]) и (VII. Двадцать три) Один- Рис.84.Редокс.
Основные (окислительно-восстановительные) элементы Неактивный электрод 180.- Если [красный] = [Ox] = 1 моль / л E-E°.Если [Oh]> [R * d], потенциал REDOC больше E°по сравнению с положительным. [О< ] <[Красный], потенциал сдвигается в отрицательную сторону direction. In редокс. Потенциал (таблица 19) обратите внимание на следующую закономерность: 1.Если стандартный окислительно-восстановительный потенциал отрицательный、
Раствор водорода действует как восстановитель(окисленная форма Более стабильный.)Активность сокращения выше и более негативна Редкий С-П от Н Ци ал. 2.Если стандартный окислительно-восстановительный потенциал положителен, то полуэлемент Водород является окислителем (более стабильное восстановление мама.)Чем больше положительный окислительно-восстановительный потенциал, тем выше окислительная мощность Половина-клеточной активности.
3. редокс^ ЭП редокс-реакция с увеличением ЭДС Пожалуйста, действуйте более энергично. Поэтому большое количество окислительно-восстановительных потенциалов может быть количественно определено Активность, направление и сила окислителей и восстановителей Окислительно-восстановительная реакция.
Смотрите также:
| Реакции нейтрализации и гидролиза | Химические источники тока. Электролиз |
| Окислительно-восстановительные реакции | Понятие о твердой фазе |
