Оглавление:








Реакции нейтрализации и гидролиза
- Реакции нейтрализации и гидролиза. Как заменить реакцию в растворе В частности, в отношении взаимодействия кислот и оснований * Т#точнее, ПР-а.. I, где A-активность. Ag * CT * «*164 В результате образуются соль и вода. Такая реакция называется реакцией. Нейтрализация. По закону ионной реакции Нейтрализация завершена、 Вещество в системе-вода НС1 + ко = примесями КС1 + Н20 Один)
- В этой системе из 4 веществ только 1 (Н20) слабо диссоциирован, и все Остальное-сильный электролит. Упрощенное ионное уравнение для этой реакции Н + + ОН » = Н2О Указывает на то, что равновесие полностью смещено при образовании воды. Сильная кислота и сильная кислотная реакция нейтрализации являются веским доказательством Основание восстанавливается до образования воды из гидроксония ионов и гидроксидов.
Ионы, то же тепловое воздействие, что и эти реакции, 1 моль Воды образуются: ДНТ = −55.76 кДж / моль. Людмила Фирмаль
Взаимная нейтрализация кислот Лот и основание, которые отличаются по прочности, не будут протекать до тех пор, пока end. So, и Взаимодействие CH3COOH (HAC) с гидроксидом калия Из 4 веществ, присутствующих в системе, 2 слабо диссоциированы: NAC + KON ^ HjO + CAC B) Или сокращенная ионная форма ВАК + о » ^ Н20 + переменного тока» Эта реакция нейтрализации обратима. Обратная связь(взаимодействие Соль с водой, в простейшем случае, образует кислоты и основания) Это называется реакцией гидролиза соли.
Реакция нейтрализации обратима за счет взаимодействия сильных кислот. Слабая базовая партия: HC1 + NH4OH ^ NH4C1 + H20 Взаимодействие слабых кислот и слабых оснований: HAC + NH4OH * = * NH4Ac + H2O С) Д) Наиболее распространенным случаем реакции нейтрализации является взаимодействие Если реакция не доходит до конца, то сила кислот и оснований разная Для обратной реакции-гидролиз полученной соли. Соль.
Сформированный сильными кислотами и сильными основаниями [реакция а)], свой гидролиз Система содержит 3 мощных электролита、 1 слабый(вода).Поэтому, согласно принципу равновесного смещения、 По отношению к ионной реакции в растворе это равновесие полностью смещается в сторону right. In Реакция B), C) и D) гидролиз протекает в значительной степени, реакция нейтральна、 Растворение является обратимым. Это связано с наличием слабого электролита на левой стороне обе.
Правая часть уравнения реакции. Поэтому причиной гидролиза является Участие в реакции слабых кислот или слабых оснований, а также в диссоциации Цитаты из самой воды. Суть гидролиза с этой точки зрения заключается в следующем Преимущественно солевые катионы (слабые основания) или их анионы (слабые кислоты) Связывает ионы OH или ионы H+, соответственно, с образованием слабого электролита (Соответственно, основание или кислота). Рассмотрим гидролиз солей образованных сильными основаниями и слабыми кислотами В лотерее.
Такие соли включают NaAc, KCN, etc. In в частности, гидролиз уксусной кислоты Натрий течет в соответствии с уравнением NaAc + H20?= * HAC + NaOH Или сокращенная ионная форма Ас » + Н20 ^ ВАК + 0ч- (Слабые электролиты появляются в форме, которая не диссоциирована).С Основание в результате гидролиза является сильным Концентрация гидроксидных ионов в растворе с последующей реакцией Щелочная среда.
Поэтому соли сильных оснований и слабых кислот Он гидролизуется при увеличении концентрации гидроксидных ионов в растворе. Соль слабого основания и сильной кислоты(хлористым аммонием nh4cl、 NH4NO3, A1C1z и др.), в процессе гидролиза основную роль играет катион соли、 Он связывает ионы гидроксида к слабому bases. In в этом случае, решение Избыток катионов водорода будет накапливаться, и реакция среды становится кислой: NH4C1 + H20 5 = * NH4OH + HCl Или сокращенная ионная форма NH; + H20 ^ NH4OH + H +
Соли слабых оснований и сильных кислот гидролизуются для увеличения 11, включение ионов водорода в раствор. Из приведенного выше примера、 Реакция среды в результате гидролиза определяется продуктами ее гидролиза、 Это сильный электролит. Гидролиз солей, образованных слабыми кислотами и слабыми кислотами Основание (NH4CN, (NH4JCO3, NH4Ac). в этом случае реакция гидролиза включает Как катионы, так и анионы солей связываются с гидроксидными ионами и ионами соответственно Водородная вода.
Таким образом, определяется реакция среды в результате гидролиза Относительная прочность образующихся слабых кислот и слабых оснований, а также В частности, гидролиз фактически протекает, но может быть близок к нейтральному Полностью. Например, ацетат аммония гидролизуется по следующему уравнению: NH4Ac + H20 ^ HAC + NH4OH Константы ионизации уксусной кислоты и гидроксида аммония равны. tf (HAc)= 1.76-U и tf (NH4OH)= 1.79-10-s. это объясняет нейтральность Реакция среды при гидролизе NH4Ac.
- Гидролиз цианида аммония NH4CN + H2O = ±NH4OH + HCN Сравнение констант ионизации кислоты и основания[A ’(HCN)= 7,2-10 0] Реакция среды говорит о том, что она есть alkaline. In контраст, гидролиз Формиат аммония hcoonh4 протекает по уравнению HCOONH4 + H20?= * HCOOH + NH4OH Как видно из сравнения, он характеризуется слабокислой реакцией среды Муравьиная кислота (к-1,8 * кг4) и константа ионизации гидроксида аммония.
Таким образом, при гидролизе солей образуются одноосновные и одноосновные кислоты Кислот-основание, единственный гидролизуемый продукт кислота и База. Соли многоосновных и многоосновных кислот、 Ступенчатый гидролиз, причем среди продуктов、 Но кислотные и основные соли. I. гидролиз солей, образованных многоосновными и одноосновными кислотами На базе слота есть 4 варианта, похожие на то, что вы можете придумать. Он не гидролизуется.
1) соли, образованные сильными кислотами и сильными основаниями (Na2SO4)、 Людмила Фирмаль
2) Соль сильной кислоты и слабого основания гидролизуется ступенчато. Образование кислых солей: (NH4JSO4 + HOH s =±NH4HSO4 + NH4OH Кислоты соли Или NHJ + HOH?= * NH4OH + H +(pH <7) Ионы водорода, которые накапливаются в растворе、 Стада стадий гидролиза(до свободной кислоты); 3) в гидролизе слабых кислот и сильных оснований, кислотных солей Соли, однако, свободные гидроксидные ионы накапливаются в растворе: Na3PO4 + HOH =?= * Na2HPO4 + NaOH Кислоты соли f + HON h = * HPOf + OH «(pH> 7)
При избытке воды (в сильно разбавленном растворе) гидролиз протекает дальше. Na2HPO4 + HOH * =±NaH2PO4 + NaOH Кислоты соли НРО2 — + НОН * = * Н2РО- +0Н- В этом случае гидролиз также не доходит до конца, так как накапливается в растворе. Гидроксид-Ион предотвращает образование фосфорной кислоты H3PO4. 4) гидролиз солей слабых оснований и слабых кислот фактически продолжается Образование кислых солей в средней стадии: (NH4JS.+ Хох?= * NH4HS + NH4OH NH4HS + HOH?= * NH4OH + ff2S
Поэтому, многоосновные кислоты и Одна кислота-основание всегда образует кислую соль, целостность гидролиза Она определяется относительной прочностью кислот и оснований. II. гидролиз солей многокислотного основания и одноосновной кислоты Она протекает поэтапно, но образуются основные соли: 1)сильной кислотой и сильным основанием соли(BaCl2)
Это был хороший день. Однако сильных кислотных оснований относительно мало (Гидроксид щелочноземельного металла); 2)сильная кислота и слабые низкопробные соли, как хлорид алюминия AlClg гидролизуется по следующей схеме. A1C13 + хох ^ А1 (он)С12 + НС1 Базовая соль A13 + + HOH * =±A1 (OHJ + + H +(pH <7) В дальнейшем А1(он) С12 + хох?= * А1(OHJC1 + НС1 А1(OHJ + + хох с ^ Ал(О); + Ч + Гидролиз не продолжается до конца, так как в растворе накапливаются ионы H + Предотвращает образование A1 (OH); 3)соли, образованные сильными основаниями поликислоты и слабокислой Они также небольшое количество.
Гидролиз цианида бария Ba (cnj только прогрессирует До образования основных солей, до накопления гидроксидных ионов в растворе、 Я рассказываю ему о щелочной реакции.: Ba (CNJ + HOH * = * Ba (OH) CN + HCN CN » + HOH?= ^ НСN + он»(рН> 7); 4) соли слабых кислот и слабые основания при гидролизе образуют основание Реакция солей и сред зависит от сравнительной прочности кислот и оснований. А1(АСК + хох 5 = ^ А1 (он) (Ацз + ВАК A1 (OH) (AcJ + HOH?= ± А1(OHJac + ВАК III. гидролиз солей многоосновных и поликислотных оснований Он может быть представлен следующими 4 вариантами: 1)сильной кислотой и сильным основанием соли сравнительно редко Обычно нерастворим в воде (BaSO4).
2) сильная кислота и слабая низкопробная соль сформированы гидролизом основания Соль и бесплатно acid. In в этом случае гидролиз не идет до конца. A12 (SO4K + 2HOH =?= ^ 2A1 (OH)SO4 + H2SO4 Al3 + + HOH * =±A1 (OHJ + + H +(pH <7)^ 3) меньше соли, образованной слабыми кислотами и сильными основаниями Они гидролизуются с образованием кислых солей и свободных оснований. 2BaS + 2NOH?= * Ба (Н + Бу (OHJ С? «+Хох?= * Нѕ — + он»(рН> 7); 4) соли слабых кислот и слабых оснований полностью гидролизуются Свободные кислоты и свободные основания от воров:
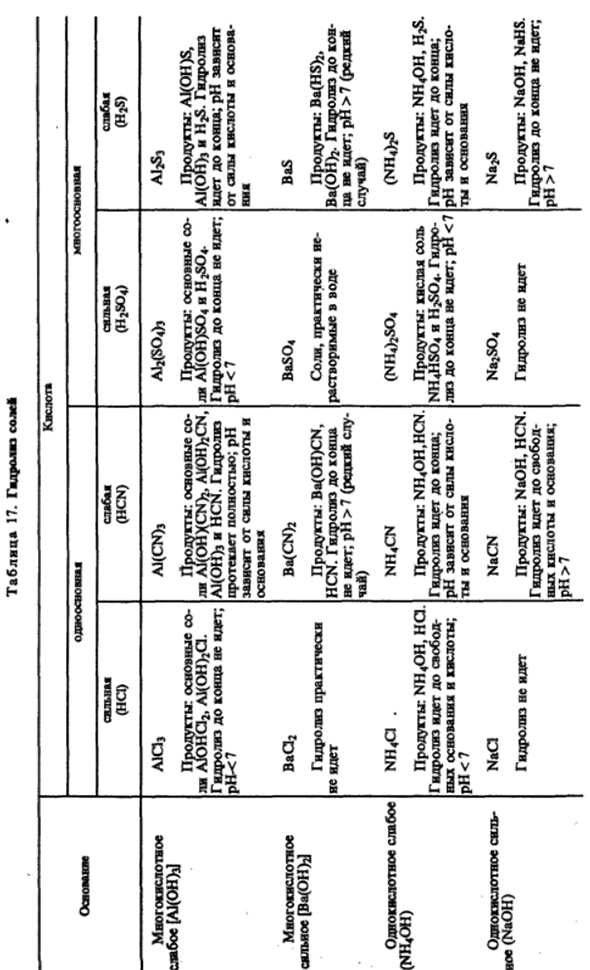
A12S3 + 6HOH = 2A1 (OHK + 3H2S Такие соли не могут существовать в водных растворах. Общая картина реакции гидролиза、 Табуляция. 17. С количественной точки зрения гидролиз в разбавленном растворе является Он характеризуется постоянным гидролизом. Например, гидролиз ионов уксусной кислоты Ас » + Хон?= * NAS + OH » Форма константы равновесия равна [Мы] [о]-] Л — [Ас -] [Н2О] ’
Концентрация нерасщепленных молекул воды постоянна. И затем… к [а] = [NACPSA = в 2 [АЦ»] г (VII Устава. Пятнадцать) Существует также постоянная величина, гидролиз constant. So … Константа, поскольку гидролиз определяется диссоциацией воды со слабыми кислотами Гидролиз удобно ассоциировать с кислотными и ионными константами ионизации Вода management. In факт, мы умножаем числитель и знаменатель формулы (VII Устава.15) [Н +]、 [США] [он -] [Н+]] С = КВт, и[Ac-] [H *] / [HAC] = LGW(HAC)、 И затем… КР = КС / кя (е Ас). (VII Устава. Шестнадцать)
Аналогично, константы гидролиза слабых оснований и сильных кислот Она выражается отношением константы ионизации к продукту ионизации воды Правильное обоснование. Например, гидролиз раствора nh4cl Кг = А (VII Устава. Семнадцать) Определены константы гидролиза солей слабых оснований и слабых кислот NH4AC Разделить по пропорциям КР = кв / [Ка (ЕАС) КБ (XE4OSCH] *. (VII Устава. Восемнадцать)
Используя принцип Ле Шателье, мы рассматриваем различные влияния. Факторы, связанные с положением гидролитического баланса. Разбавление раствора Соли, это соответствует увеличению на 1% концентрации реагента (воды). Способствует hydrolysis. In напротив, гидролиз концентрированных солевых растворов В меньшей степени. Повышение температуры влияет на гидролиз Главным образом из-за резкой температурной зависимости порядка. Диссоциация water.
So, при нагревании концентрация ионов H +и OH Потому что решение значительно увеличится、 Образование слабо диссоциированной кислоты или основания, и высокая Гидролиз протекает более полно. Обратимым гидролизом солей сильных кислот и слабых оснований、 В результате кислотность среды повышается, а добавление кислоты подавляется Hydrolysis. As результат гидролиза, свободный сильный Гидролиз можно ингибировать путем введения дополнительного COL в качестве основания Щелочное качество.
Смотрите также:
| Водородный показатель. Индикаторы | Окислительно-восстановительные реакции |
| Обменные реакции между ионами. Произведение растворимости | Гетерогенные реакции в растворах |
