Оглавление:
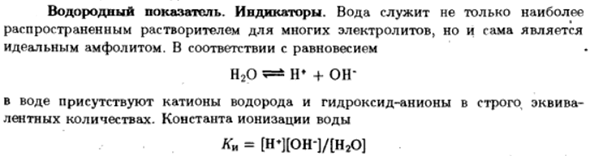



Водородный показатель. Индикаторы
- Вода не только самая полезная Общий растворитель для многих электролитов, но сам по себе Идеальный амфотерный electrolyte. By весы Н2О 5 =±Н + + О- В воде есть строго эквивалентные катионы водорода и анионы гидроксида Количество ленты. Константа ионизации воды КК = [Н*] [он -] / [Н2О] —. — ¦ .! ….
- Сто пятьдесят девять Его можно определить по проводимости. Концентрация не диссоциации, потому что вода является очень слабым электролитом Молекула равна общему количеству молей, содержащихся в 1 литре воды, то есть [H2O] = 1000/18 = 55,56 моль / л KI [E2O] = [H+] [OH«] или [Н+] [ОН-] = 1.8-10-16-55.56 = 。10-14 Величина[H+] [OH -] = 10-14 кВт называется ионным произведением water. So …
Измерения показывают 22. 1.8-10〜16 то есть диссоциация воды очень незначительна. Людмила Фирмаль
В случае воды концентрация гидратированных ионов равна、 [Н+] = [ОН «] = = 10 моль / л При добавлении кислоты концентрация ионов водорода увеличивается, и, соответственно,、 Концентрация гидроксидных ионов、 Температура ионных продуктов воды является постоянной величиной. Когда добавить Фото напротив щелочи наблюдается. Следовательно, концентрация ионов Водорода в растворе выступает как мера кислотности или щелочности среды.
В Кислотный раствор[H +]> 10, щелочной [H +] <10.Пожалуйста, введите значение Логарифм основания 10 концентрации ионов водорода、 это называется рН.: рН = — LG [Н +] *. (VII. одиннадцать) Затем для нейтральной среды рН = — rglo-7 = 7, для кислого раствора рН <7 и Для щелочного рН> 7.Аналогично, реакция среды является Обработанный с так называемым гидроксильным индексом: пох =- (VII. двенадцать)
Для воды pH = pOH = 7, а также изменения pOH в кислых и щелочных растворах противоположность изменения рН. Пролог продукта Иона воды поднимая、 Мы получаем (VII Устава. Тринадцать) + и LG [он-] = −14. Если взять отрицательный логарифм, то получится следующее соотношение рН + Рон = 14. В растворе рН может изменяться greatly. So, и pH1 (pOH 13) [H +] = 10 моль / л, и [OH »] = 10 3 моль / л 0,1 Н раствор кислоты. Для 1 м раствора кислоты, [H +] = 1 моль / л, рН 0 (rON 14), то есть [OH»] = 10 4 моль / л, для 10 Н раствора кислоты рН равен −1、 rON 15, то есть [OH«] = 10 5 моль / л
- Раствор соляной кислоты всегда существует в ничтожных количествах Гидроксид Ион. * Точнее, pH = — lea+, где o-активность. н Аналогично, для щелочных растворов, при 0,1 Н рН 13. Раствор NaOH, а именно rON 1, следовательно[H +] = 10 3 моль /л,[OH «] = 10 моль / л. 1N случай Раствор NaOH pH 14 и pH 0, т. е.[H +] = 10 „и моль / л, и [OD ’] = 1 моль / л. Водородный индикатор Юнь. Щелочной раствор должен быть равен 15 [OH“] = 10 миль / ч / л pOH-1, по сути, раствор со значением рН менее 0 рН> 14 встречается редко.
Для определения рН мы используем так называемый кислотно-щелочной индикатор Каштан, который является слабой органической кислотой и слабым основанием Он имеет другой цвет с диссоциированной молекулярной массой forms. So … 、 В общем случае выражение может быть выражено как Hind.
Индикатором фенолфталеина является слабая органическая кислота Людмила Фирмаль
In водный раствор Фенолфталеин диссоциирует по схеме Лань Бесцветный Ч+ Индия」 Мали-Новый Кроме того, концентрация окрашенных ионов Можно проигнорировать. Если добавить щелочь, то баланс переместится вправо、 Потому что ионы водопода связывают к ионам окисоводопода и диссоциируют немножко Водные молекулы. Поэтому в щелочной среде раствор получит малина Раск. При работе в кислой среде в качестве индикаторов используются слабые индикаторы Органические основания диссоциируют по схеме Индо?= * Инд + + о »
Раскраски раскраски я второй Увеличение концентрации ионов водорода (увеличение кислотности среды) будет смещаться Равновесие вправо обусловлено связыванием ионов он, и наблюдаются изменения Цвет самого solution. In стол. 16 показаны наиболее распространенные кислоты Диапазон рН, в котором происходят основные показатели и изменения Раскраска.
Смотрите также:
| Кислотно-основная ионизация | Обменные реакции между ионами. Произведение растворимости |
| Теории кислот и оснований | Реакции нейтрализации и гидролиза |
