Оглавление:





Кислоты
- Кислота В предыдущем разделе мы уже сталкивались с соляной кислотой HCl, серной кислотой H2S04 и соляной кислотой НР03.Там очень много кислоты. Но все они имеют общие черты. Их молекулы состоят из атомов водорода (которые могут быть заменены металлами) и кислоты residues.
- So например, в молекуле серной кислоты H2S04 атом водорода легко заменяется атомом цинка, а атом цинка соединяется с двухвалентной кислотой Остальная часть этого сформирует соль ZnS04: I p и Zn + H2S04 ZnS04 + H2t В молекуле ортофосфорной кислоты H3P04 атом водорода замещается атомом кальция, который связывается с остатком трехвалентной кислоты^ P04. У меня есть ш и ЗСа + 2н3р04 — > — СА3 (P04) 2-ф — 3h2t
Валентность кислотных остатков определяется числом атомов водорода, которые могут быть заменены на metals. Людмила Фирмаль
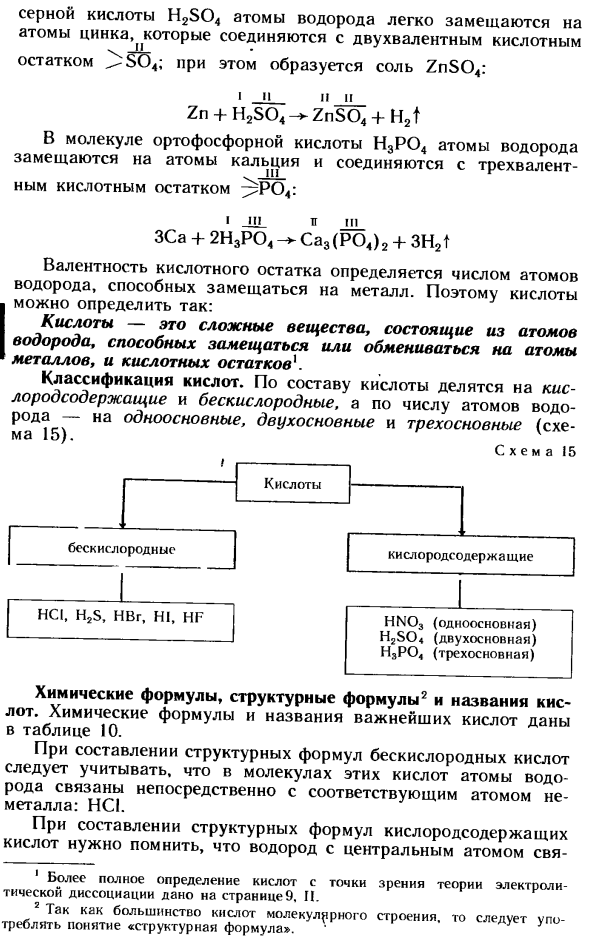
So, кислота может быть определена как: Кислота представляет собой сложное вещество, состоящее из атомов водорода и остатков кислоты, которые могут быть обменены или обменены с атомами металла Классификация кислот. В зависимости от состава кислоту делят на кислородсодержащую и бескислородную, в зависимости от количества атомов водорода-одноосновную, двухосновную, трехосновную( МА15 > — схема 15 Химическая формула, структурная формула 2 и название кислоты.
В таблице 10 приведены химическая формула и названия наиболее важных кислот. При составлении структурной формулы бескислородной кислоты, следует отметить, что в молекулах этих кислот, атомы водорода непосредственно присоединен к соответствующему неметаллических атом-Нсl. При составлении структурной формулы кислородсодержащих кислот, следует отметить, что водород является центральным атомом 1.
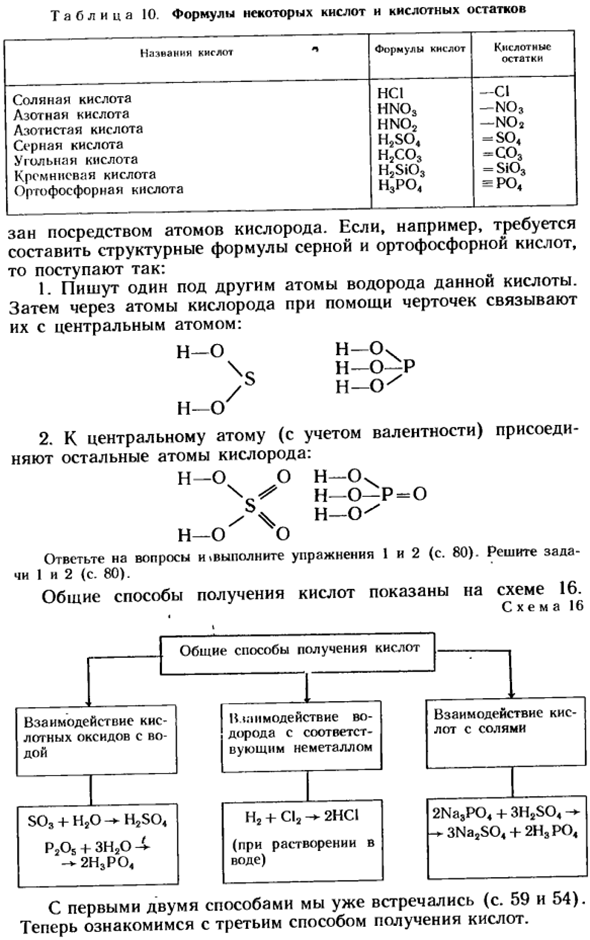
Более полное определение кислоты в терминах теории электролитической диссоциации приведено на стр. 9 п. 2 большинство кислот имеют молекулярную структуру, поэтому следует использовать термин «структурная формула». Таблица 10.
Формулы некоторых кислот и кислотных остатков Формула кислоты Никто Кислотный остаток Соляная кислота соляная кислота серная кислота кремниевая кислота фосфорная кислота НС1-КИ Разработка плана,-с бортовым номером 03 hno2 с-nо2 н2ѕо4 = сц4 H2CO3-CO3 HjSiO, Si03 Ч, по4 = по4 Атомы кислорода занимают. Например, если вам нужно создать структурную формулу для серной и фосфорной кислот: 1.1. под остальными атомами водорода данной кислоты запишите один.
Затем, через атом кислорода с помощью черточки, мы связываем их с центральным атомом. Нет Н-Очь \ ДЧ-О-П / Н-О ’ Да. 2.Оставшиеся атомы кислорода связываются с центральным атомом (с учетом его валентности): Ч-С) О Ч-О. НЕТ-П-0 н / д / нет В ответ на вопрос: «выполните упражнения 1 и 2(стр. 80).Задача I и 2 (стр. 80). Схема 16 показывает популярный способ получения кислоты. Образец 16 Первые 2 способа(стр. 59 и 54).Далее мы поговорим о 3-м способе получения кислот.
Небольшое количество высушенного хлорида натрия помещают в пробирку (рис.45), наливают на нее концентрированную серную кислоту и закрывают пробку пробкой с газоотводной трубкой. Опустите конец трубки в другую трубку. Затем тщательно нагрейте смесь хлорида натрия и концентрированной серной кислоты acid. In в этом случае выделяется бесцветный газ, который испускает дым в воздухе. air.
It представляет собой хлористый водород, который также образуется при сгорании водорода в хлоре(стр. 54). Когда трубка полна. 45.Получение хлористого водорода. Закрыт газом, пробка、 С закрытым концом опустите его в воду и снимите пробку. Хлористый водород хорошо растворяется в воде, поэтому вся трубка заполнена водой. water. In в полученный раствор добавляют фиолетовую лакмусовую бумажку, которая получается red.
As в результате при растворении хлористого водорода в воде образуется соляная кислота. Реакция отражается в следующем уравнении: Na2S04 + 2 HCI t + H2iso4 Назик. В этой реакции взаимодействуют 2 сложных вещества, компоненты которых обмениваются местами. Это обменная реакция. Обменная реакция называется реакцией между 2 комплексными веществами, в которой компоненты обмениваются местами.
Реакция нейтрализации (стр. 73) является частным случаем обменных реакций. В следующих случаях обменная реакция будет последней (то есть фактически жизнеспособной). 1) если 1 из образованного вещества является volatile. So например, выделяется хлористый водород, газообразное вещество, поэтому обменная реакция между хлоридом натрия и концентрированной серной кислотой продолжается до конца. 2) если 1 из образовавшихся веществ осаждается в insoluble.
- At время получения нерастворимых оснований, знакомство с этим случаем(стр. 71). 3) Если в результате реакции образуется вода. Типичным примером является реакция нейтрализации(<;. 73). Учитывая летучесть, прочность и растворимость кислот (нерастворимая кремниевая кислота H2Si03), их обычно можно расположить в порядке отделения друг от друга солей. Эта строка равна 1. H2S04, HC1, HN03, H3P04, H2S03,H2C03, H2S, H2Si03 Аналог.
Например, концентрированная серная кислота вступает в реакцию с солями азотной, соляной и фосфорной кислот. Например, реакция нитрата натрия с соляной кислотой практически не может быть осуществлена, так как летучесть и прочность соляной кислоты и азотной кислоты практически одинаковы.
Ответьте на вопросы 3 и 4 (стр. 80).Физические свойства кислот. Людмила Фирмаль
Многие кислоты, такие как серная, азотная и соляная кислоты, являются бесцветными жидкостями. Твердая кислота также известна как: ортофосфорная кислота NaP04, металлин НР03, борная кислота н3вое. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты Кремниевая H2Si03. Кислый раствор имеет кислый вкус. Химические свойства кислот. 1.Раствор кислоты окрашивает лакмус в красный цвет, а метиловый Апельсин-в розовый.
2.1. одним из важнейших химических свойств кислот является способность вступать в реакцию с определенными metals. In в этих реакциях обычно выделяется водород и образуются соли. Zn + 2HCI ZnCl2 + H2f Чтобы выяснить, какие металлы заменяют водород из кислот, российский ученый Н. N. It руководствуется серией металлических работ (1826-1911), определенных экспериментально Бекетовым (1865). К, Na, Са, MG, Алюминия, Цинка, Железа, Никеля, Олова, Свинца, Ч, КР, Серебро, Платина, Au2.
В этой серии Все металлы, которые находятся перед водородом, могут быть заменены водородом из кислот. Исключение составляет азотная кислота. При взаимодействии с металлами вместо водорода выделяются другие газы. 3.Кислоты взаимодействуют с основными оксидами. CuO + H2S04-V C11SO4 + H20 4.Кислота вступает в реакцию с основанием: NaOH + HCl NaCl + H20 5.Кислота реагирует с солью: _ ZnCI2 + H2S04 ZnS04 +2НС11 1
Эта серия является условной. Однако в большинстве случаев реакция между кислотами и солями протекает именно по этому ряду. 2 Самое последнее описание и название этой серии металлов можно найти на стр. 89 (11). Реакция протекает в соответствии с набором кислотных замен. 6.При нагревании некоторые кислоты разлагаются. H2Si03 — ^ H20 + Si02 Приложение.
Использование наиболее важных кислот рассмотрено в соответствующем разделе(соляная кислота-146 страниц, серная кислота-100 страниц, азотио-II, 35 страниц, ортофосфорная кислота-II, 41 страница). * y ответьте на вопросы и выполните упражнения 5-9.Решите Задачу 3.* I. Что такое вещество, называемое кислотой? Напишите в блокноте следующую таблицу, в соответствующей колонке выведите химическую формулу кислоты, подчеркните кислотный остаток и отметьте его валентность.
Кислота Бескислородный одноосный биационный подшипник tribasic 2.Создайте следующую структурную формулу кислот: б) бромистоводородная кислота; в) сера; г) соляная кислота 4. 3.Как получают кислоту? Создайте уравнение реакции. 4.Вы можете получить следующие 2 способа. фосфорная кислота. б) сероводородная кислота? Напишите уравнение соответствующей реакции. 5.Запишите в блокнот следующую таблицу и запишите 3 уравнения реакции, в которых участвует кислота и образуется в соответствующей колонке.
Реакция реакция реакция реакция реакция реакция Декомпозиция интегрированных замещающих заменителей 6.Приведите 3 уравнения химических реакций, характеризующих химические свойства кислот. Обратите внимание на тип реакции, с которым они связаны. 7.Какое из веществ, которым дана формула, реагирует с соляной кислотой: а)CuO; 6)C)Cu(OH) 2; d) Ag; d) A1(OH)?Напишите уравнение жизнеспособной реакции. 8.Рассмотрим следующую схему реакций: Zn + HCI Cu + HCI Mg-f H2S04 Li + H2S04 NaCI + HCI-H3P04 + H2S04 Na2S04-f HCI Na2COs + HCI Fe (OH) 3 + HNO-NaCI + HNO、
Напишите уравнение жизнеспособной реакции. 9. Напишите резюме ответов о свойствах соляной, серной и фосфорной кислот в соответствии с планом, представленным на стр. 43. 1.Какая кислота богата фосфором-ортофосфорная кислота H3P04 или металлин HPO3? 2. 5 декабря 3.95.It содержит элементы Селена Se (относительная атомная масса Se 79) и 0,1 5 месяцев. В том числе и водород. 3.Напишите уравнение реакции сульфата железа (II) и серной кислоты и рассчитайте массовое соотношение между элементами в молекуле реакции и образующимся веществом.
Смотрите также:
| Определение массовой доли растворенного | Оксиды |
| Основания в химии | Амфотерные гидрокды и оксиды |
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
