Оглавление:



Классификация элементов
- Классификация изделий К 70-м годам прошлого века уже было обнаружено 63 химических элемента. discovered. In в химии, как и в других науках (ботанике, зоологии), по мере накопления фактов возникла необходимость в классификации. Металл и non-metal. An элемент, образующий оксиды и гидроксиды с амфотерными соединениями properties.
- As вы уже знаете(стр. 17), что первая классификация химических элементов заключалась в разделении на металлы и неметаллы. Рассматривая его химические свойства, оказывается, что существуют химические элементы, которые нельзя отнести ни к типичному металлу, ни к типичному неметаллу.
Однако, эта классификация была слишком общей и недостаточной. Людмила Фирмаль
К ним относятся, например, цинк, алюминий и некоторые другие элементы, оксиды и гидроксиды которых обладают амфотерными свойствами (повторите§ 4 В главе IV). Если мы сравним свойства химических элементов, расположенных в восходящем порядке относительных атомных масс в будущем, то увидим, что наблюдаются прогрессивные переходы от типичных металлов к элементам, в которых оксиды и гидроксиды амфотерны, и от них к типичным неметаллам.
Поэтому классификация химических элементов на металлы и неметаллы является относительной. Понятие группы сходных elements. In в поисках лучшей классификации ученые-химики попытались сгруппировать все элементы по их характеристикам.
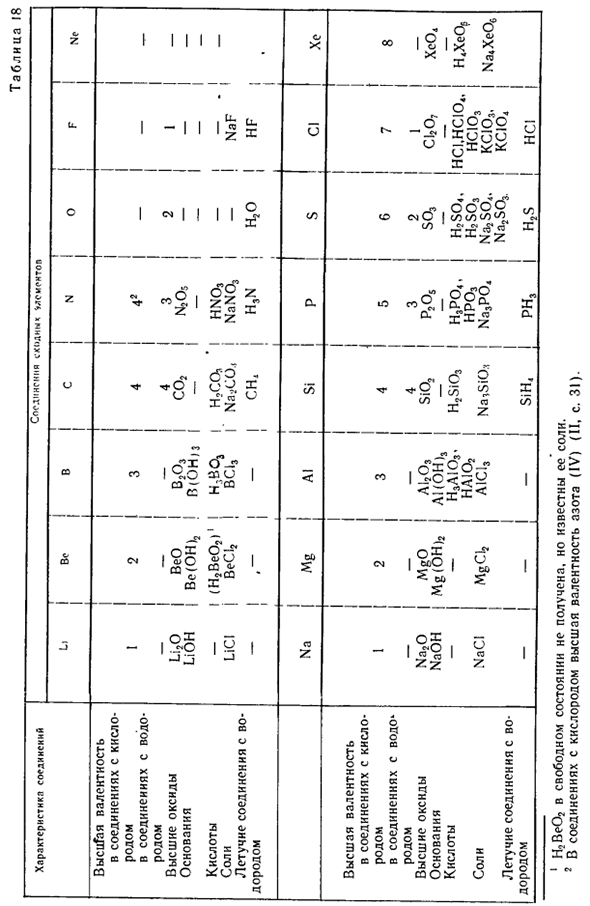
При знакомстве с основными классами кислорода, водорода, воды и неорганических соединений (оснований, кислот, оксидов, солей) мы уже сталкивались с химическими элементами, которые можно классифицировать на отдельные группы соединений со сходными свойствами. properties. So например, при изучении химических свойств воды мы убедились, что элементы натрия Na и калия K вступают в реакцию с водой.
Литий Li, рубидий Rb, цезий Cs, и Fr. It видно, что элементы этого типа также обладают схожими свойствами. При взаимодействии с водой все эти элементы образуют щелочи, поэтому их называют щелочными металлами. Все щелочные металлы являются одновалентными и имеют сходные соединения по форме и свойствам(таблица 18).
Он также знаком с элементами магния (Mg) и кальция (Ca).Подобным им является бериллий Be(табл. 41. 18), а также стронций Sr, барий Ba и Ra Ra. Эти элементы также образуют соединения, близкие по форме и характеристикам. Характерный представитель трехвалентных элементов Алюминий А1 доступен. Бор В и некоторые другие элементы подобны Ему. 」
- Углеродные элементы образуют соединения как с кислородом, так и с водородом, такие как монооксид углерода (IV) CO2 и метан CH4.Кремний Si, Германий Ge (широко используемый в полупроводниках), олово Sn, по элементам свинца Pb, это наводит на мысль о морфологии и свойствах соединения. Все они образуют типы соединений IVII IV I H2O и RH4.
Что касается азотных элементов, то известны соединения с кислородом V II III I Соединения типа R2Os и RH3 также образуют другие элементы, такие как фосфор P, мышьяк As, сурьма Sb и висмут Bi. Аналоги также характерны для кислорода и серы. In соединения, содержащие водород 1, они являются двухвалентными и содержат соединения типа H2R, например H20 и Н2Ѕ.В высоких оксидов, эти элементы шестивалентный、 VI и Соединения типа S03, например S03.
Это се селен и теллур Te. Людмила Фирмаль
Me-Я. Элемент хлора C1 образует соединения водорода и HCI. VII II Кислород-лучший оксид с!207.Родственными элементами являются фтор F, бром Bg и йод I. Все они являются одновалентными для соединений, содержащих водород. Они характеризуются соединениями типа HR и、 VII II Некоторые из них (хлор, бром, йод) являются высокими оксидами типа R207.
Инертный элемент (стр. 44) также представляет собой группу аналогичных элементов 2.Некоторые из них высоко-ксеноновые, например ксенон Xe (Xe04) 8-валентности. Многие химики (немецкие ученые И. Дебинер (1780-1849) и Л. Мейер(1830-1895), англичанин Дж. Ньюленд(1838-1898), француз А. Шанкертова (1819-1886) и др.) предлагали различные варианты классификации. Химический элемент.
Однако объединить эти группы в единое целое не представлялось возможным. Только открытие Менделеевым периодического закона химических элементов, одного из самых фундаментальных законов природы, позволило создать единую систему. В ответ на этот вопрос, упражнения 1-3 (стр. 121).
Смотрите также:
| Объемные отношения газов при химических реакциях | Открытие периодического закона химических элементов Д. И. Менделеевым |
| Тепловой эффект химических реакций | Строение атома |
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
