Оглавление:








Строение атома
- Атомная структура VI и VII классы§ 104 и 105 повторяются в учебнике физики. Периодические законы Менделеева и высказанные на их основе гипотезы послужили стимулом к разгадке строения атома. Эксперименты Э. Резерфорда доказали, что в центре атома находится положительно заряженное ядро, величина которого совпадает с порядковым номером элемента.
- Американский физик Р. Милликен экспериментально доказал, что электрон имеет наименьший отрицательный заряд(1909-1914).Так как атом в целом электрически нейтрален, то число электронов, движущихся вокруг ядра атома, должно быть равно порядковому числу атомов. element. So например, серийный номер элемента калия равен 19.Таким образом, заряд его атомного ядра равен+ 19.
Вокруг ядра калия имеется 19 электронов с общим отрицательным зарядом −19. Людмила Фирмаль
В результате серийный номер химического элемента совпадает с зарядом атомного ядра атома. В будущем мы будем проверять, что ядерный заряд является более значительной величиной, чем атомная масса элемента. Поэтому вы узнаете больше о строении атомного ядра. Состав атомного ядра. В 1896 году французский ученый Беккерель обнаружил, что элемент урана U испускает лучи, подобные рентгеновским.
Ученые Мария Кюри-скродовская и Пьер Кюри обнаружили, что одни и те же лучи испускают одинаковые, но более сильные элементы радия Ra и полония Ro. Эти элементы и 1 серебро также проявляет другие валентности, но наиболее характерным является одновалентное соединение. Многое другое называется радиоактивностью, что является именно явлением радиоактивности.
Для изучения свойств излучения небольшое количество «соли радия» помещали в небольшой свинцовый ящик с отверстием наверху (свинец поглощает лучи радия).Ящик с солями радия был помещен в электрическую камеру. field. In кроме того, было установлено, что радиоактивное излучение неоднородно (рис. 46)
Дальнейшие исследования показали, что Р-линия представляет собой поток известных частиц-электронов, а-линия представляет собой массу 4 и заряд+ 2,А лучи подобны рентгеновским лучам. I. In в последующих экспериментах мы также обнаружили, что в результате высвобождения и улучшения частиц а и Р атомы радия распадаются, образуя 2 новых элемента-радон Rn и гелий He1. * gRa 2ijRn + » нет Уже известно, что в химических реакциях атомы сохраняются, и только перегруппировка occurs.
In этот процесс, в отличие от химической реакции, 1 атом превращается в другой. Процесс превращения одного элемента в другой, называется ядерной реакцией. 1. Благодаря открытию радиоактивности ученые окончательно убедились, что в состав атома входят электроны и положительно заряженные частицы(а-частицы).
Однако эти частицы нельзя было считать элементом (их масса равна 1 и 7 соответственно), так как невозможно было объяснить строение атомных ядер многих элементов, таких как водород, литий и др. Частицы с зарядом +1 и массой 1.Такие частицы назывались protons.
It естественно было предположить, что в состав атомного ядра также входит нейтральная частица с массой 1, так как масса атома кроме атома водорода всегда больше массы, занимающей Протон. Эти частицы назывались нейтронами. Изотопы. В ходе экспериментальных исследований, например, было установлено, что в природном кислороде, помимо атомов с массой 16, имеются также атомы с массой 17 и 18.
Соотношение их выглядит следующим образом: _ ’»0:1 Иоанн: Чо = 99.759: 0.037: 0.204 1. в ядерных реакциях с химическими символами элементов верхняя цифра обозначает атомную массу, а нижняя-заряд атомного ядра. Рисунок 46.Разделение радиоактивного излучения в электрическом поле. Оказывается, что другие элементы состоят из атомов разных masses.
So например, в природной воде, кроме атома водорода массы I, есть еще 2 атома массы. Соотношение этих атомов выглядит следующим образом: | Н:? N = 5000: 1 Водород с атомной массой 3 также был получен в ядерной реакции. Типы атомов одного и того же элемента, масса которых различна, называются изотопами, хотя число протонов в атомном ядре одинаково.
«Изотоп» означает «занимают одно и то же место«.Например, атомы IEO, g70, J80 с одинаковым ядерным зарядом являются изотопами кислорода, и| H.?Атом H — это изотоп водорода. Легкий изотоп водорода| H называется протиевой, изотоп, ч дейтерия(D) и изотопа называется тритий(Т) (рис. 47). Открытие и эксперименты по радиоактивности в Резерфорде сыграли очень большую роль в развитии знаний о строении материи.
1.In в практике искусственных ядерных реакций было доказано, что в состав атомных ядер входят протоны и нейтроны. На этой основе была разработана протонно-нейтронная теория атомных ядер. created. It было установлено, что в ядре атома протия jH имеется 1 протон, в ядре атома дейтерия-1 протон и нейтрон, а в ядре атома алюминия-13 протонов и 14 нейтронов.
Если известны относительная атомная масса элемента (Ar) и его порядковый номер (Z), то число нейтронов (N) можно найти в разности N-A, — Z. 2.При изучении продуктов естественных и техногенных ядерных реакций были открыты изотопы. На этой основе удалось углубить и расширить знания о химических элементах(стр. 15).Согласно принципу изотопов, понятие «химические элементы» формулируется следующим образом: Химический элемент-это своего рода атом с одинаковым ядерным зарядом.
Почему атомная масса большинства элементов равна доле? Оказывается, необходимо различать понятия «относительная атомная масса»и» относительная атомная масса элементов».Атомная масса действительно очень близка к целому числу、 Рисунок 47.Изотопы борролола. Это масса отдельных изотопов. Атомная масса элемента выражается в виде дроби. Например, относительная атомная масса элемента хлор* а равна 35.5.
It нетрудно понять разницу между этими понятиями. Элемент хлора состоит из 35 изотопов, массовое число которых очень близко к 37 и 2.Изотоп * 7С\содержится в природной смеси на 75%, изотоп ’ C1-25%.So, средняя атомная масса элемента хлора равна: 35•0.75 + 37•0.25 = 35.5•в некоторых случаях стало ясно, почему элементы с большим серийным номером имеют меньшую атомную массу, чем элементы с меньшим серийным номером. Например, аргон Ar и калий K, теллур эти и йод I.
- It видно, что это зависит от того, от какого изотопа (тяжелого или легкого) зависит данный элемент. Калиевый элемент состоит в основном из легких изотопов и аргона. Ответьте на вопросы, упражнения 8-13(стр. 121). Расположение электронов на энергетическом уровне. Электроны в атоме различаются по запасу энергии, энергии, которую они приобретают или излучают в определенных частях, так называемых квантов.
Величина электронной энергии атома водорода зависит от основного квантового числа n. It могут быть выражены только целыми числами-1,2, 3, 4 и т. д. Электроны с минимальным количеством энергии (n = 1) размещаются на первом энергетическом уровне, или электронном слое.
Приобретая квантовую энергию, электрон переходит на 2-й энергетический уровень (n = 2). Людмила Фирмаль
Число электронов N на энергетическом уровне определяется по формуле: N = 2n2 Согласно этой формуле, 2 электрона имеют первый энергетический уровень (n — \ 2•I2 = 2), 2-й электрон равен 8 (n= 2; 2•22 = 8)、3-й электрон (n= 3; 2•32) = 18)-18 электроны и т. д. В элементах 1-го периода атома есть только 2 энергетических уровня, в которые помещается менее 2 электронов. Атом водорода H имеет 1 электрон, а атом гелия He имеет 2 электрона.
В случае атома лития Li (серийный номер 3) Первый Электрон уже заполнен, поэтому 3-й электрон помещается на 2-ю энергию level. In итого, 8 электронов вписываются во 2-ю энергию level. So, во 2-м периоде есть 8 элементов, от лития Li до неона Ne. Электронная начинка 3-й энергетической урбвни несколько иная. Во-первых, 8 электронов от Na натрия (1 электрон) к AR аргона (8 электронов) помещены дальше it.
At в этот момент электронное наполнение 3-го энергетического уровня временно прекращается.19-й электрон атома калия K и 20-й электрон атома кальция Ca Не 3-й, а 4-й энергетический уровень. Атомная структура этих элементов выглядит следующим образом: + 19К 2 года, Сб., 7 Мая, Сб., 8, 2 ч. Начиная со скандиевого элемента Sc (серийный номер 21), содержащего цинковый элемент Zn (серийный номер 30), возобновляется заполнение 3-го энергетического уровня и накапливаются 4-е-2-е электроны.
Структура атома скандия Sc n цинка Zn выглядит следующим образом: + 2iSc2ë. 8-й. 9. 2×4. 3oZn2ë, 8ё, 18ё, 2ё С галлиевого элемента Ga (серийный номер 31) возобновляется заполнение электронов до внешнего энергетического уровня до тех пор, пока число неактивных элементов Криптона Kr, hx, не достигнет 8, и завершается 4-й период.
Здесь вопрос возник в связи с открытием периодического закона (стр. 11)8) вернемся назад и ответим на них, опираясь на полученные знания о строении атома. 1.Заряд атомного ядра (порядковый номер) определяет химические свойства элемента. Это объясняется тем, что при увеличении заряда ядра на единицу появляются новые электроны, которые обычно находятся на внешнем энергетическом уровне ядра. atom.
It видно, что электроны на внешнем уровне более подвижны, и валентность элементов зависит от их количества. Поэтому их называют валентными электронами. Заряд ядра является главным свойством элемента. Например, калий K, хотя и имеет меньшую атомную массу, чем аргон Ar(таблица* 19), заряд его ядра составляет еще 1 ( + , то есть Ar,+ 19K).
Поэтому калию присваивается следующий серийный номер 19.Поскольку последний 19-й электрон находится на 4-м внешнем энергетическом уровне, последний (11-й) электрон подобен натрию, помещенному на 3-м внешнем энергетическом уровне, и входит в группу щелочных металлов. 2.Сущность периодичности объясняется тем, что при увеличении заряда атомного ядра элемента элементы с одинаковым числом валентных электронов регулярно повторяются.
Например, периодическая воспроизводимость свойств литиевых элементов Li, натрия Na и калия K объясняется тем, что атомы всех этих элементов на внешнем энергетическом уровне имеют 1 валентный электрон. В большинстве случаев, при увеличении ядерных зарядов, их относительная атомная масса закономерно возрастает. increases.
In в этой ситуации Д. И. Менделеев открыл периодический закон, позволивший расположить элементы в порядке возрастания атомной массы. Основываясь на теории строения атома, периодический закон Д. И. Менделеева теперь формулируется следующим образом: Химические элементы и свойства простых элементов, образуемых ими Сложные вещества периодически зависят от величины ядерного заряда атомов этих элементов.
Понятие о состоянии электронов в атоме. Ученые считали, что электроны вращаются вокруг положительных атомных ядер и находятся на определенном расстоянии от них. Теперь доказано, что орбит таких атомов не существует. Используя расчеты и экспериментальные данные, ученые установили, что электроны в движении могут находиться вблизи или далеко от ядра атома. atom. It также удалось установить вероятность присутствия электрона на определенном расстоянии от ядра.
Если проследить вероятность того, что электрон находится в направлении увеличения радиуса атома водорода, то получается, что он равен нулю в самом ядре, быстро увеличивается от ядра, достигая своего максимального значения на расстоянии 0,53•10-10 м от ядра, а затем постепенно уменьшается. Частота электронов на определенном расстоянии от ядра обычно выражается формулой dot. In места, где электроны остаются чаще, точки устанавливаются чаще tightly.
As в результате электроны в движении образуют сферическое облако, а плотность атомов водорода максимальна на расстоянии 0,53•10-10-10 м от ядра атома (рис.48).Электроны, образующие сферические облака в движении, обычно являются s-электронами. Электронное облако также называют орбитальным. Атом гелия он имеет 2 s электронов.
Поэтому возникают проблемы. Почему 2 сферических электронных облака могут сосуществовать на одном энергетическом уровне? Помимо движения вокруг уже изученного ядра, электроны также имеют движение, которое можно выразить как вращение вокруг собственной оси. Это вращение называется спином (по-английски lane-spindle).
Электронное облако одинаковой формы может перекрываться, если электрон имеет противоположный (антипараллельный) спин, то есть один вращается по часовой стрелке вокруг оси, а другой-против часовой стрелки. Используя эти понятия, расположение электронов в атоме представлено с помощью электронных формул. Например, ч-Ис1,он-это.
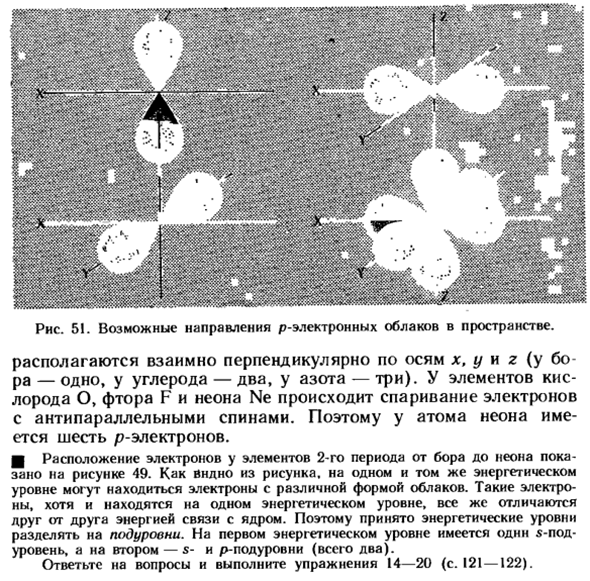
Цифра перед буквой обозначает количество энергетических уровней, буква-это поток электронного облака (рис. 49), цифра в правом верхнем углу буквы- Рисунок 48.Форма электронного облака атомов водорода. 5!。Возможное направление движения Р-электронных облаков в пространстве. Они расположены перпендикулярно друг другу вдоль осей x, y и z (6°, 1, углерод, 2, азот, 3).Для элементов, кислорода о, фтора F, а не-Неон, электроны в паре с антипараллельными спинами. Итак, неон атом имеет 6 р-электронов.
Расположение электронов в элементах 2-го периода от Бора до неона показано на рисунке 49.As как видно из рисунка, электроны в виде различных облаков находятся на одном энергетическом уровне. Такие электроны находятся на одном энергетическом уровне, но все же отличаются друг от друга энергией связи с ядром. Поэтому принято делить энергетический уровень на sub-levels. In на первом энергетическом уровне есть 1 «- подуровень», на втором-s-и/>-подуровни (всего 2). Отвечая на этот вопрос, выполните упражнение 14-20(стр. 121-122).
Смотрите также:
| Классификация элементов | Периодическая система Д. И. Менделеева |
| Открытие периодического закона химических элементов Д. И. Менделеевым | Значение периодического закона |
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
