Оглавление:




Металлическая связь
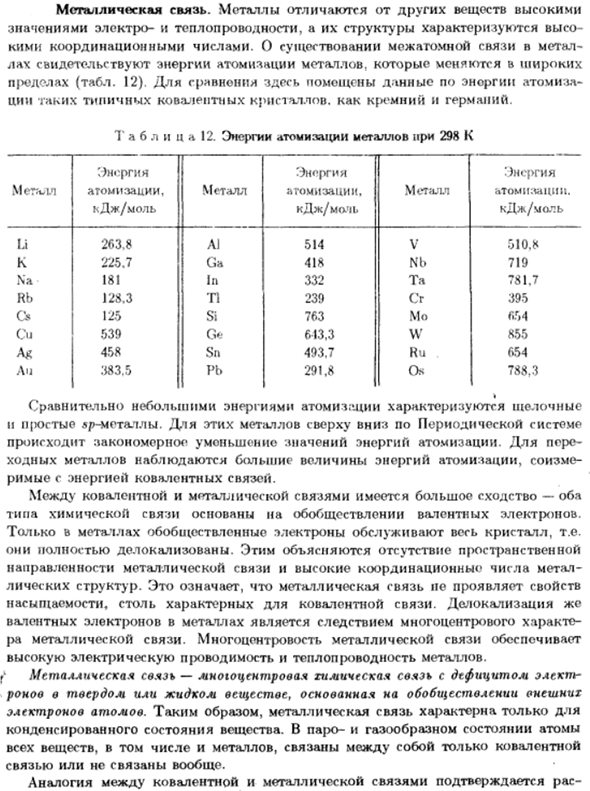
- Металлическая связь. Металлы отличаются от других веществ Значение электрической и тепловой проводимости, а также их структура、 Номер регулировки. О наличии межатомных связей в металлах Лах свидетельствует о значительном изменении энергии распыления металлов. Ограничения (таблица 12).
- Для сравнения приведены данные по энергии распыления Эти типичные кристаллы доли как кремний и германий. Относительно небольшая энергия распыления характеризуется щелочностью И простой sp металл. Для этих металлов, верхняя часть к дну системы цикла Значение энергии атомизации будет, естественно, снижаться. Рим с энергетическими ковалентными связями.
Вновь Для переходных металлов наблюдается большая энергия распыления. Людмила Фирмаль
Существует много сходств между ковалентными и металлическими связями-как Тип химической связи, основанный на социализации валентных электронов. Обобществленные электроны служат всему кристаллу только металлом. Они полностью делокализованы. Это объясняет нехватку места Направленности металлической связи и высокое координационное число металла Строение листьев. Это означает, что металлическая связь не проявляет никаких свойств. Насыщение, характерное для ковалентных связей.
Делокализация Переход валентных электронов в металлах является результатом multichemistry металлическая связь РА. Обеспеченное скрепление металла мульти-ядра Высокая электрическая и теплопроводность металлов. Ф-металлическая связь-multichemistry связь с электрическими дефектами * На основе внешней социализации, твердого или жидкого вещества лонов Атомы электронов.
Таким образом, металлическая связь является Конденсированное состояние matter. In состояния пара и газа, атомы Он связан между собой только ковалентными связями всех веществ, в том числе и металлов Он подключен или не подключен вообще. Сходство ковалентных и металлических связей、 94. Распределение электронной плотности между ядрами. Оба типа Связывание пространства между ядрами остается значительным Электронная плотность, образование электронных мостиков между взаимодействиями Мой атом (рис. 58).
Разница заключается в ковалентных связях. Мост определяет строго пространственную ориентацию、 Металлическая связь, электронная плотность распределена равномерно во всем Направление. Метод BC не может интерпретировать металл bonds. In эти металлы Если число координаций велико, то валентность очень коротка Электрон по сравнению с двух-электрон и два цента ковалентные связи Общение.
С точки зрения ИМО, металлические облигации характеризуются дефицитом Электроны для нормальных ковалентных связей. Таким образом, порядок общения Металлическим и истинно металлизированным может быть любая фракция. Отсюда Металлизированные, как правило, не следуют правилам классической валентности. То есть, делимость. Из-за этого невозможно предсказать Определите состав рецептуры, исходя из классической идеи валентности、 Поэтому здесь нужны другие понятия.
- Металлические связи не исключают ковалентных связей. Металл Чистое сцепление характерно только для щелочных и щелочноземельных металлов. нью-йоркский металл. Многие физические свойства других металлов, особенно переходные (Температура плавления и кипения, энергия распыливания, твердость, межатомная Расстояние) только для того, чтобы показать неприводимость химических связей Металл.
Установлены современные методы физических исследований В переходных металлах только часть валентных электронов Он находится в состоянии социализации. Число электронов, принадлежащих всем Малый—1 электрон / атом. Например, такая типичная миграция- Металлы, такие как ниобий, имеют концентрацию электронов, которые обобществляются в общей сложности Только 1,2 процента атома ниобия.
Оставшиеся электроны выполняют ковалентную связь, направленную между соседними атомами. Людмила Фирмаль
Перекрывающихся направлений Электронное облако уже наблюдалось с помощью простого sp-металла, но специального Во время проведения transition. sJ металл. Потому что он большой. Размер и сложная геометрия (/- электронное облако. Для переходных металлов характерна высокая температура плавления Высокое значение энергии кипения и распыления, основное перекрытие между радиочастотными траекториями и образованием со- Соединение ленты.
Это особенно заметно в середине десятилетия элементов плагина. Его атомы характеризуются максимальным числом неспаренных электронов (Рисунок 59). В настоящее время все основные свойства металла Это определяется характером металлической связи. Но самое специфическое Качественно отличают конденсированный металл от других веществ Состояние-это отрицательный температурный коэффициент электричества Проводимость.
Это означает, что при падении температуры металл уменьшается Электропроводность. И как носитель металлических токов Когда социализированные электроны движутся вперед. Начало 20-го века. Тяжелая работа и Лоренц применительно к электронам проводимости Были введены металлическая кинетическая теория газов и понятие электронного газа.
Эта теория свободных электронов относится к закону Ома Электропроводность и теплопроводность(закон Видемана-Франца), но То есть основное отличие металла от других твердых тел, а именно Температурная зависимость электропроводности. Конечно. Теория свободных электронов и кинетическая энергия электронов Дрю и Лоренца Равный КТ. (IV. двадцать три) Где k-постоянная Больцмана. (IV. 23), когда температура повышается Электронная скорость v увеличивается и вместе с ней Мост.
Однако с повышением температуры электропроводность уменьшается Это особенность металла. Поведение электронов проводимости правильно описывается квантовой теорией. Ее металл, применение квантовой статистики Металл. Его начальное выражение: 1) электроны системы неразличимы. Два) Принудительное осуществление принципов Паули, а именно в системе этого государства Только 1 электрон может быть помещен с указанной ориентацией спина.
Три) Изменение состояния электрона определяется по меньшей мере 1 изменением. 4 квантовых числа. Расчет с учетом основных положений Квантовая статистика применительно к металлам позволяет выводить уравнения Эо = 36.1(ч0 / (IV. двадцать четыре) Где Eq-энергия Ферми*. «О — это число электронов проводимости на атом. Vq-молярный объем металла. *
Энергия Ферми-это максимальная энергия, которой обладает электрон В металле при T = O K Что? 3.16 К 2.06 Rb 1.76 Cs 1,53 Cu 7.10 АГ 5.52 АС 5.56 Ниже приведено значение энергии Ферми металла группы I. Система (для% = 1): Металл Ли Эо, эВ 4.74 Согласно квантовой теории, даже при T = 0 K энергия электрона металла Измеряется в нескольких электронных вольтах.
Согласно классической теории электронов Средняя электронная энергия газа при комнатной температуре равна B93. 2 к) −0.03 будет равно eV. So в реальности (квантовая теория) Электроны металла, находящиеся уже при 0 К, имеют на 2 порядка большую энергию, чем энергия Он рассчитан в соответствии с кинетической теорией газа при комнатной температуре. Отсюда Повышение температуры практически не влияет на скорость электронов.
Такие как Состояние системы называется degeneracy. As в результате, в металле Электроны проводимости вырождаются энергетически. Вырождение электронов является основной причиной, и в результате При повышении температуры проводимость металла уменьшается. С ростом Температура увеличивает амплитуду атомных колебаний узлов Кристалла Сетки, которые приводят к более сильному рассеянию электронов.
Для этого Средний свободный путь электронов уменьшается, а степень подвижности уменьшается. Колебания атомных ядер решеток в современной физике уподобляются стоянию Чем звуковые волны. Квант звуковых волн называется фононами. По мере увеличения Энергия фонона увеличивается и рассеяние увеличивается Электронов на фононах. Таким образом, снижение электропроводности Повышение температуры (токопроводящий ход металла)、 Подвижность при почти постоянной концентрации электронов Мост.
Смотрите также:
| Понятие о методе молекулярных орбиталей | Химическая связь в твердых неорганических веществах |
| Сравнение МВС и ММО | Силы Ван-дер-Ваальса |
