Оглавление:






Понятие о методе молекулярных орбиталей
- Концепция молекулярно-орбитального метода. Более универсального квантового Химический способ описания химической связи-это молекула Орбита (ИМО), Леонард Джонс, Гандо, особенно А я нет sure. In этот метод, электронное состояние многоатомной системы является Подобно электронам в атоме, они образованы молекулярными орбиталями (МО Он характеризуется атомными орбиталями (АО). в то же время, как АО, так и МО Одна электронная волновая функция каждого атома или молекулы Но.
- Разница в том, что АО-это единый центр, а МО-МУЛЬТИЦЕНТР Высокая траектория. Система как «многоядерный атом», в котором существуют электроны Существует молекулярная орбиталь. Одноэлектронное приближение IMO обычно является、 Форма МО ЛКАО, что означает » молекулярная орбиталь» Как линейная комбинация атомных орбиталей. ^^ 0 \ i J ^ B принцип метода MO LCAO на примере молекулы водорода Да, сделайте то Cg. As до этого φ и φ-волновые функции электронов Водородные атомы Na и СГ.
Таким образом, ИМО-это квантово-химический метод описания химических веществ Связывание молекул и многоатомных атомов Людмила Фирмаль
Согласно основной идее метода МО ЛКАО, волновая функция электрона в молекуле Н2 Это написано так: Т \ 2Фъ — (Ив. Девятнадцать) Рисунок 50.Цена объем Азотированная решетка Металлический литий МО Восемьдесят восемь Коэффициенты Ai и A2 указывают на процент участия соответствующего АО. Дизайн МО. Если а]> А2, АО ФА、 Сравнение Мо и COf. In взаимодействие различных атомов\и A2 служат Мера полярности communication. In факт, если\> A2, то вероятность пребывания Электрон атома в индексе 1 больше, чем электрон атома в индексе 2.Это、 Указывает, что электроотрицательность первого атома больше, чем у второго. Таким образом, метод MO LCAO автоматически учитывает поляризацию химических веществ Общение.
Энергия образования МО определяется по формуле (IV. 6) и рассчитывается по формуле: выражение Потенциальная энергия системы аналогична энергии, выраженной в МВС. (Ив.19).6) вычислите энергию системы Е, подставив ее. Представлен в виде алгебраической суммы Е = М± (Ив. Двадцать) Где Q-Кулоновский Интеграл. / ? — Обменный интеграл. Как и MVS, Интеграл обмена имеет отрицательный знак и Q€//?Есть и|.Если Å = Г + / ?Затем происходит связывание молекулярной орбитали (QS).Энергия Гидратация системы снижается(рис. 51). QS соответствует симметричной волновой функции Государство Х \ ФА (IV. двадцать один)
Из-за перекрытия электронных облаков、 Увеличение плотности электронного облака(рис. 52). Обратная волновая функция Ф= — (IV. двадцать два) Е-Г -/?У нас есть широкий спектр продуктов на выбор. (RMO).в последнем случае энергия выше, чем начальная AO(рисунок 51) и происходит Уменьшение электронной плотности пространства между ядрами (рис. 52) и многое другое Объясните отталкивание атомов.
Таким образом, оба электрона в молекуле водорода Энергетический уровень находится в QS, что ниже уровня AO. By Сходство с атомными орбиталями (s, p, d, f) также подразумевает молекулярную орбиталь P и s. 51.Энергетическая схема АО и МО в системе из 2 атомов движение водорода / модель SMO РМО Рисунок 52.Распределение электронной плотности в системе 2 атома водорода Восемьдесят девять Он начинается с соответствующих букв греческого алфавита a, m, 8 и<p. расслабьтесь Молекулярная орбиталь имеет звездочку.
Электронный Прочность энергетических и химических связей уменьшается. Сама РМО электронные Это называется ослаблением. Для QS добавление электронов увеличивается Энергия связи. Электроны QS также называются связями. Количество МО Он равен общему количеству источников АО. Когда молекулы водорода образуются из 2 АО получил 2 мес.1-QS, а 1-RMO (рис. 51). При расчете многоатомного МО (начиная с трех атомных молекул)、 Отображается уровень энергии между QS и RMO. Такой МО называется несвязанной молекулярной орбиталью (НМО).
В какой-то степени НМО характеризует энергию электронов на AO. In генерал、 4 вида молекулярной орбитали внутренних электронов СМО, РМО, НМО И валентные электроны NMO*. В появлении МО в методе МО ЛКАО、 Специфические условия:1) Энергия АО、 Друзья-они равны по размеру. 2) Максимальное электронное перекрытие Облака взаимодействуют с АО; 3) АО нуждается в тех же свойствах- Симметрия относительно оси молекулы (например, может взаимодействовать АО px и px, но вы не можете объединить px с pu или px с pz. In добавление, заполнение-
Электроны в МО происходят следующим образом: Системная энергия; б) принцип Паули: в) правила Гунда. Метод МО не требует понятия валентности、「 Ряд гвяги.»Порядок связи равен фактору, делящему разницу в количестве электричества Новые возможности в QS и RMO обусловлены количеством взаимодействующих атомов. Порядок общения Он принимает как целочисленные, так и десятичные значения, но только положительные. Если порядок связи равен нулю, то система нестабильна и никакой связи не происходит place.
It есть Означает появление молекулы или любой многоатомной системы Популяция электронов в QS всегда должна быть больше, чем Население РМО. И полученная система энергетически полезна、 Есть такой Вирно. Порядок коммуникации Имо существенно трансформируется Многообразие коммуникации в МВС, форма понятия валентности классической chemistry. Net Локальное значение порядка связи, многоцентровости и Делокализация связей в методе МО.
Рассмотрим некоторые соединения с точки зрения ИМО. До Все-молекулярные ионы водорода не интерпретируются как принцип В рамках МВС метод МО является самым простым и понятным. Разница Популяция QS c \ s \ между молекулой водорода и Ионом B * В молекуле этой орбиты есть 2 электрона(рис.51), 1-в Ионе. Порядок связи молекул водорода равен 1, а порядок связи молекулярных ионов равен 0,5. При удалении электронов из SMO энергия связи ионов уменьшается, так что H ^ меньше Он сильнее, чем молекула Hg и также известен как молекулярный Ион H〜.
- Третий(по (По сравнению с Н2) электроны могут быть помещены только в рыхлый МО -. Молекулярная орбиталь<r * s (рис. 51).Порядок связывания отрицательных молекул таков Полярный ион водорода также будет равен 0,5.Однако, скрепленная прочность N-очень * QS и концепции РВД применяются только для валентных электронов. 90. С МО Диаграмма 53.Схемы обучения от АО o-j-CMO и<t * 51-RMO ГМО P и s. 54.Схемы обучения от Мы-семейный и управляемый бизнес.
Маленький А6. 7 кДж / моль), чтобы уменьшить анергию электронной популяции RMO Общение. В этой гипотезе, очевидно, молекула гелия HE2 не встречается. В образовании 2 электрона находятся на QS, а другие 2 — на QS- В РМО. Таким образом, порядок связи является zero. At то же время известно Молекулярный Ион He энергия диссоциации которого близка к энергии диссоциации * Ч цитата^. Молекулярные ионы гелия в SMO имеют 2 электрона、 РМО-1.
Это будет определять его стабильное существование. Не так, как он-2. Людмила Фирмаль
Состав BE2 образует молекулы, такие как Ca2, Ba2 и Mg2. В дополнение к энергетической фигуре образования МО(рис. 51)、 Укажите форму молекулярного электронного облака, полученного из исходного атома Орбита перекрытием (SMO), или, наоборот, отталкиванием(RMO). На рис. 53-55 показаны различные симметрии QS и. Схема формирования RMO показывает*. На рисунке 53 показано взаимодействие атомов водорода с электронным облаком Образование молекулярных связей и разрыхление электронных облаков Водород. Рисунок 54: p ^мы видим, что атом возникает во время взаимодействия облаков ют и-МО, а не в-МО.
Полученный SMO содержит осевой цилиндр ГХ ГХ Он не может быть представлен г-MO, потому что это symmetric. In этот факт, в частности、 Rx Это влияет на разницу между АО и МО. только если существует взаимодействие между P-и P ^ -ОРБИ- Атомная талия образуется в x-и g-MO соответственно. Последние 2 мес энергии ВЗ Ру Он генетически модифицирован. Для сравнения, MMO и MVS рассматривают вышеупомянутые молекулы азота С позиции МВС. На рисунке 56 показаны энергетические структуры и популяция сферы. Подъем молекул азота.
Полностью заполненная ls орбита атома азота Они не участвуют в формировании связей. Таким образом получается 2 атома азота n = 2 производит только 10 валентных электронов (Bs22p3).Полностью 2-й электрон введите <Р25-и<Р * ^ — МО. Они не способствуют формированию коммуникации, потому что Число электронов в SMO точно равно числу электронов в RMO. Шесть Р- Электроны размещаются в МО следующим образом: 2 электрона-на<t2p-MO, и 4 электрона-на 2 дегенерата которых R2P-МО.
Таким образом, в молекуле азота имеет 8 Есть 2 свободных электрона, то есть порядок связи таков 3.In Дело в том, что валентные электроны атома азота составляют всего 3 Br3)、 МО обозначается как индекс начальных атомных орбиталей. Лл! Я ОУП С МО Рис.55.Схемы обучения от АО ЖР-СМО и 1г * Р-РМО АО МО Рис.56.Энергетическая диаграмма и Населенность орбиты молекул азота 2.9 поскольку электроны сами по себе не участвуют в образовании химических веществ Connection.
So, молекула азота имеет 6 Это электрон, но в RMO нет ни одного электрона. Это объясняет огромную энергию. Диссоциация на атомы N2 и диамагнетизм молекул азота. Молекул гетероатома, химическая структура молекулы азота Характеристики и свойства молекул монооксида углерода. Молекулярная населения Орбита CO в точности совпадает с орбитой молекул азота (рис.56).Разница Он входит только в структуру АО.
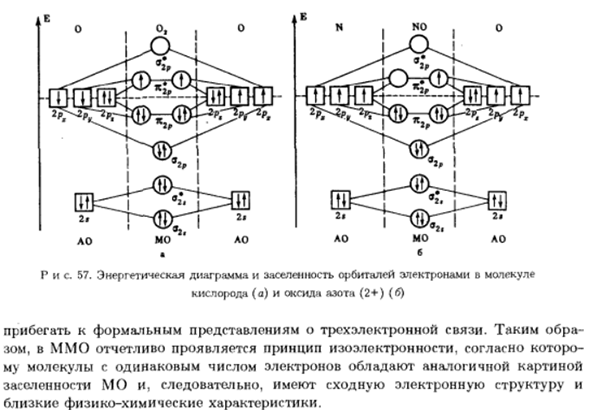
На стороне углерода、 МО имеет 4 электрона, а на стороне кислорода-6 электронов. Порядок общения 3, то есть соответствует множественности связи в СО на основе MIF. Сравненный к пятнам азота, 2 молекулы кислорода Рон большой. Молекула кислорода MO энергетическая фигура и население Это показано на рисунке. 57.Во-первых, порядок связи в O2 равен 2.Второй 2 вырожденных x * — RMO, 1 непарный электрон( Правила игры).Они парамагнитный»виновников.»
Кура oxygen. So, в ИМО, парамагнетизм O2 строго оправдан Научно не стоит предполагать 3 электронных сообщения. По сравнению с молекулярным кислородом Ион O *(диоксигенильный катион) кислород kyoke составляет менее 1 электрона. Это x * — RMO Есть только 1 электрон(рисунок 57). Порядок связи O *равен 2.5.И затем Величина порядка связи велика, а число электронов в ОМА невелико Это приводит к тому, что он сильнее молекул кислорода.
Энергия диссоциации Молекула кислорода на атом равна 497 кДж / моль, а в случае о ^она достигает 643 кДж / моль. Электронные гетероатомные оксидные молекулы, такие как диоксигенилкислоты 627 кДж / моль азота с энергией диссоциации на атомы (+2). так… Высокая прочность молекул N0 и их парамагнетизм、 База ИМО(рис. 57).Это свидетельство еще больше убеждает в подобном Молекулы типа Og, N0, в принципе, не возможны, а главное, они не нужны Интерпретируйте его с точки зрения МВС.
Тогда в этом нет необходимости АО МО Диаграмма 57.Заселение орбит электронами в энергетической диаграмме и молекуле Кислород (а) и азотоводородная окись б+) (б) 3. полагайтесь на формальные представления об электронном communications. It-это не так. Так, в ИМО четко продемонстрирован принцип изоэлектричества. Молекулы с одинаковым числом электронов имеют сходные изображения. Население МО, а следовательно, имеет аналогичную электронную структуру、 Близок к физико-химическим свойствам.
Смотрите также:
| Кратность химической связи | Сравнение МВС и ММО |
| О связях с избытком и дефицитом валентных электронов | Металлическая связь |
