Оглавление:



Кратность химической связи
- Разнообразие химических связей. Мультисоединение-ковалентная связь, ОС- Множественный электрон pairs. In молекула этилена, C2H <j Каждый из возбужденных атомов углерода восприимчив к β-гибридизации. Два-гибрид Орбитали используются для образования связей с 2 атомами водорода、 3-я гибридная орбиталь-сочетается с другим углеродом atom. It-это не так.
- Для каждого атома углерода, еще 1 непарный 2p- К электронным. «В гибридизации P2 электронное облако равно 1 Плоскости под углом 120°друг к другу. Из эксперимента Полученные данные означают, что молекула этилена имеет плоскую структуру (Рис. 44). Линия, соединяющая атомное ядро-химическая связь Ось симметрии, соединяющая электронные облака, называется связью А.
(Т-связи возникают, когда происходит фронтальное перекрытие атомных орбиталей. Людмила Фирмаль
Каждый атом углерода образует 3 < t связи этилена. 2 других с 2 атомами водорода. Атомы углерода не являются гибкими Орбитальные орбитали образуют так называемую π-связь. Химические связи、 Связанное электронное облако имеет только плоскость симметрии、 Прохождение через ядро атома называется g-связью. Рисунок 44 соединение TG до сих пор Это пунктирная линия line. In факт, во время формирования тг «Перекрывающиеся атомные орбиты(рис. 45).
Таким образом, 2 связи между атомами углерода этилена не эквивалентны. 1 из них-это соединение, а еще 1-соединение tg. Дубликат электронного облака Формирование тг-связей происходит less. In кроме того, области перекрытия являются、 < Т ядер, чем образование связей. По этим причинам облигация Tg имеет оно имеет низкую прочность сравненную к скреплению cg. Следовательно, энергия двойной связи Всегда меньше, чем в 2 раза энергия одной связи, которая является связью С.
- Кроме того, он-Бонд имеет осевую цилиндрическую симметрию、 Тело вращения вокруг линии, соединение Атомное ядро. Наоборот, тг-общение Цилиндрической симметрией. Это Это главная причина. 1 группа возможно свободное вращение Коммуникация является относительно разных Атом углерода молекулы этилена. Поэтому невозможно свободно заниматься спортом Фрагмент молекулы вращается в двойном Ной и тройная связь; Выделяют 2 типа молекул этилена. Джи-Бонд.
G связь между атомами углерода、 Н Рис.44.Структура молекулы этилена Рисунок 45.Различные виды тг-выпуска облигаций и (Т-выпуска облигаций Он образован перекрытием 2 с / электронных облаков и обозначается 2. При образовании с-связей между атомами углерода и водорода со сторон Собственные атомы участвуют в^ 2 орбиталях, а атомы водорода-в s орбиталях. По.
Поэтому этот тип it-соединения обозначается как». Людмила Фирмаль
Существует химическая связь с-СЗЗ Инжир. инжир. тг-свя- 。 5-связи образуются путем перекрытия з-д Зи делится на него Что ж, р-р — р-а — а-а 8шт все траектории движения РФ. Энергия диссоциации на атомы 945 кДж / моль. Раньше, потому что атом азота уже нормальный、 В этом состоянии находятся 3 неспаренных электрона. Между атомами азота 、 Существуют тройные связи: 1 и 2 г. по экспериментальным данным、 п — п-п-п-п разрывное усилие с-связи очень велико и эквивалентно 543,4 кДж / моль. Простой.
(Негибридная) а-связь не характеризуется такой высокой энергией р-р-р Диссоциация. Когда молекула азота образуется, каждый атом становится sp- Гибридизация и 2 f-электрона остаются негибридными. Гибридный зазор И-соединение требует довольно много энергии. Эффект самый лучший. Более большое перекрытие электронного cloud. It это молекула азота. 2 л облигации, созданные для 2 чистых не-гибридных орбит、 р-р-р Каждый атом имеет 1 гибрид и связи, которые вносят в него свой вклад СП-СП Важный вклад в энергию молекул.
Естественно, 2 соединения П-П Он перпендикулярен к каждому other. In кроме того, атом азота включает в себя Неэквивалентная траектория (рис. 46). Приведенный пример дает основание утверждать, что всегда существует одна связь Да, это чисто или гибридное соединение cg. Двойной связью 1 1 подключается. Наконец, тройная связь состоит из 1 а связи и 2 м связи、 Они расположены перпендикулярно друг другу.
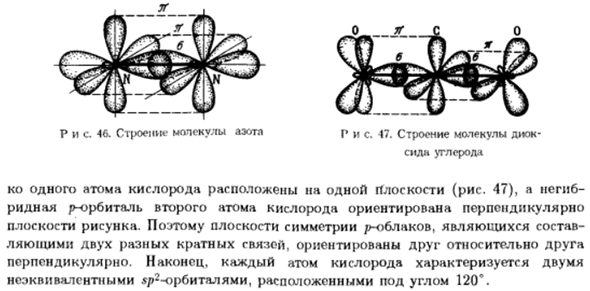
В углекислом газе также наблюдается гибридизация центрального атома. Что касается атомов кислорода, то в результате их образования происходит β-гибридизация Каждый атом имеет 1 чистый / электрон、 Он связан с образованием тг-связей. Отсюда и двойная связь между Опять же, мать углерода и кислорода, 1 гибрид<Т- СП ^ — СП 1 чисто обязательного тг.«Центральный атом углекислого газа имеет 4 Электронное облако.2 из них-гибриды. Последние 2 и чистый район- Восемьдесят пять Рисунок 46.
Структура молекул азота P и s. 47.Молекулярная структура Сода углеродистая 1 атом кислорода находится на одной плоскости (рис. 47), точка перегиба Гребневые орбиты 2-го атома кислорода ориентированы вертикально Рисование surface. So плоскость симметрии / meblack равна、 2 различные множественные связи, связанные друг с другом Вертикально. Наконец, каждый атом кислорода равен 2 Неэквивалентные » m> 2 орбиты, расположенные под углом 120°.
Смотрите также:
| Поляризация химической связи | О связях с избытком и дефицитом валентных электронов |
| Направленность ковалентной связи | Понятие о методе молекулярных орбиталей |
