Оглавление:




Поляризация химической связи
- Поляризация химических связей. Ковалентные связи являются только гомеополярными * Для молекул и соединений, состоящих из одинаковых атомов. И такие вещества Не может быть больше количества периодических элементов (с учетом одинаковых особенностей) Система.
- В настоящее время металлические и металлизированные (в основном Существует более 10 000 связей металл-металл. It есть Происходит потому, что большинство соединений образуются Разные atoms. In в этом случае происходит сцепление электронов Капельное облако под воздействием 1 атома-поляризация, результат Это полярная связь.
Все остальное. Соединение характеризуется полярным ковалентом bond. Людмила Фирмаль
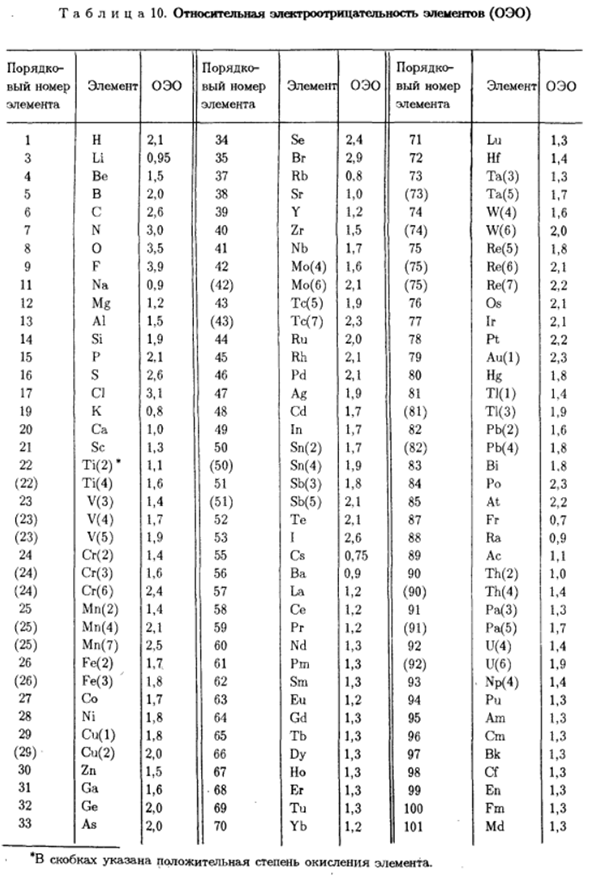
Происходит сдвиг связывающего электронного облака К более электроотрицательным атомам. Сродство с потенциалом ионизации Кроме электронов, он не может функционировать как достаточная мера электроотрицательности Идентификатор элемента. Малликен предложил количественную меру электроотрицательности. Сродство с атомами в виде полуматиана первого ионизационного потенциала Электронный EO = (/+ E) / 2 (IV. Семнадцать) /-
Это первый потенциал ионизации. E-это электронное сродство. Однако в отличие от потенциала ионизации、 Точность любого элемента со спектральными данными, для электронов Не существует надежного метода количественной оценки yet. So … Полинг пошел другим путем и выразил значение электроотрицательности Элемент в относительной единице измерения.
Согласно опросу, энергия диссоциации AB D (A〜B) соединения должно составлять более половины полной энергии диссоциации. Молекулы A2 и B2 отдельно, разница между D (A ~~ B) и semimai Обозначается Д: Д =?>(А-Б) — У2 [?(А-А)+ Н(Б-Б)]、 (Ив. Восемнадцать) Здесь D (A〜A) и D (B〜B) — соответствующие энергии диссоциации молекул Ar и B2. Если атомы а и в химически взаимодействуют друг с другом, то D не может быть отрицательным- Фактическое значение.
Таким образом, при взаимодействии Hg и HBr образование HBr является ДУ-Бр)= 364.9.?>(H-H)= 432,2 и D (Br-Br)= 192,7 кДж / моль. И затем… Д = 364.9-1/2 Д32. 2 + 192,7)= 52,45 кДж. Анализ экспериментальных данных показывает, что опрос Такое относительное значение электричества (OEO), разность конкретного соединения равна 0,102 / d. ниже приводится значение 0,102[и в некоторых химических связях: Согласно квантовой механике, делокализация электронов этих веществ、
Возможно, существует мгновенный диполь. Однако средняя статистическая картина такова Соединение, состоящее из идентичных атомов, является дип-свободным и гомоэополярным. Связь Si-H Д 8.78 0.102 [а * 0.30 ОЭО разница 0.3 ВГ-Н 52,5 0.74 0.7 И 96.9 1.00 1,0 Как-ХЛ 99.5 1.01 1,0 с-ки 22.1 0.58 0.5 Ф-С1 65.6 0.82 0.9 ВГ-1 7.1 0.27 0.3 * 0.102 [А=, | Д / 96.485 эВ. В шкале электроотрицательности, каждому химическому элементу присваивается Ясное значение для OEO является given. In стол.
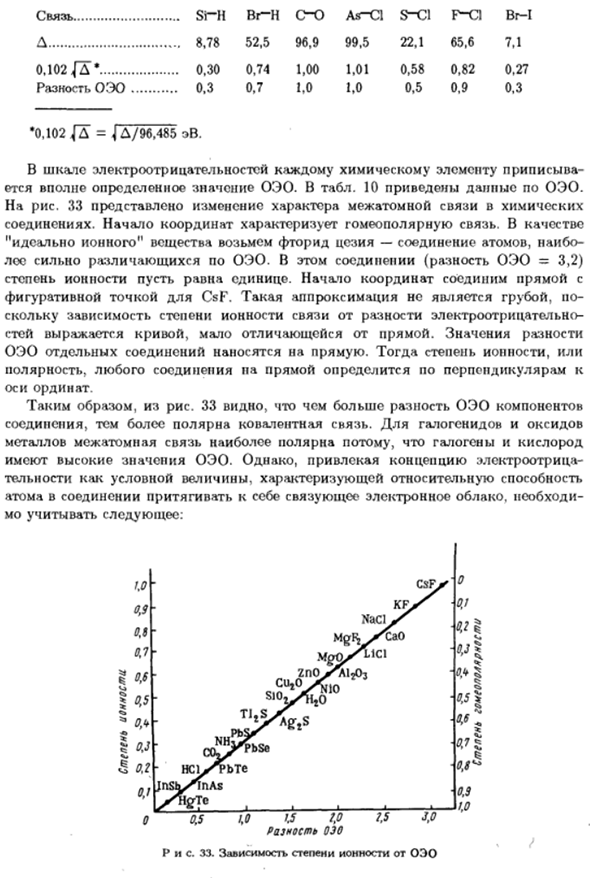
На рисунке 10 показаны данные wee. На рисунке 33 показано изменение природы межатомной связи химического вещества Соединение. Происхождение характеризует гомеополяр relationship. As Возьмем фторид цезия, который представляет собой соединение атомов OEO очень отличается. Это соединение (OEO разница= 3,2) Сделайте степень ионности равной 1.Начало координат соединено следующими прямыми линиями Точка зрения КСФ. Такое приближение не является грубым.
- Потому что зависимость связи от степени ионной разности электроотрицательна стей представлен кривой, которая почти не отличается от прямой линии. Значение разницы Индивидуальное соединение OEO применяется непосредственно. Затем, степень ионности, или Полярность соединения на проводе равна、 Вертикальная ось. Следовательно, из рисунка. 33 чем больше разница в компонентах OEE, тем больше понимание. Соединение, ковалентные связи более полярные.
Для галогенидов и оксида Межатомная связь является наиболее полярной. Ценность ви высока. Вы можете рассмотреть следующее: 1) электроотрицательность не является строгой физической величиной、 Определите сразу; 2) величина электроотрицательности не постоянна и зависит от природы Другой атом, в котором атомы химически связаны.
Тем не менее, концепция electronec-привлекает Активность как условная величина, характеризующая относительные способности Атомы в соединении, которое притягивает к себе связанное электронное облако、 Людмила Фирмаль
3) один и тот же атом данной химической связи, но иногда одновременно Действует как электропозитивный (донор), так и электроотрицательный Твердое тело (акцептор). Как правило, полярные ковалентные связи интерпретируются на основе того, о чем вы думаете Электроотрицательность. Чем больше 2-й компонент, 0E0, тем больше Поскольку ковалентные связи подвергаются поляризации, доля ионов Communication.
At в то же время, проблема степени ионной или полярности связей Соединение имеет диаметрально противоположное положение, то есть С точки зрения поляризации ионов. Молекула Различие образуется полным движением электронов, изолированных Собственная личность и сдержанные ионы. То есть электронный сдвиг под действием Эффект электрического поля, создаваемого ионами, заключается в поляризации ионов.
Поляризация-это двунаправленный процесс Действие и поляризуемость ионов. Поляризуемость-способность электронов Облако деформированных частиц под действием другого электростатического поля Интенсивность гомологичного Иона и этого электрического поля определяет поляризационное действие Иона. На самом деле, с катионным Поляризуемость анионов. Влияние поляризации катиона главным образом Зависит от его электронной структуры, заряда (степени окисления )、
Радиус. Чем меньше радиус внешнего электрона и главное квантовое число Чем больше орбиталь и заряд ионов, тем больше эффект поляризации Бороться. Поэтому малые катионы обладают сильным поляризационным эффектом. Первая линия периодической системы, особенно при движении слева направо Право.Поляризуемость аниона зависит от тех же факторов, что и поляризуемость Эффекты катионного действия.
Анионы с большим радиусом (размером) и зарядом Больше поляризуйте. Чем больше основное квантовое число внешнего электрона Орбита аниона, его скорость поляризации равна high. In то же самое главное Квантовое число p электронное облако、- Облако. Поляризационный эффект катионного、 Облака облако от anions. As в результате ионная природа химических связей уменьшается、 И степень ковалентных связей возрастает. Связь становится полярной ковалентной связью Ной. Поэтому, поляризацией Иона、
Связывание и его эффекты противоположны поляризации ковалентных связей. Исходя из концепции поляризации ионов, рассмотрим элемент хлорид 3-й период цикла : NaCl Раствор mgcl2 с A1C13 4+ Сикл、 5+ PCI5 Слева направо заряд увеличивается, а радиус поляризатора уменьшается — Катионный-тот же хлоридный анион; в результате, в том же направлении、 Рения усиливает поляризационный эффект катиона, и в зависимости от этого Например, вымышленный катионный Р5 +. ** На самом деле, соединение SCle не существует. 7 дней Ионная природа межатомной связи уменьшается естественным образом.
Хлорид натрия Тетрахлорид кремния, который составляет большинство ионных соединений Полярность относительно низкая, виртуальный склероз практически отсутствует Homeopolar. To тот же вывод о свойствах межатомных связей Может исходить из концепции электроотрицательности-поляризации Первоначально это была гомеополярная коммуникация. Но гомеополярная связь на самом деле Он существует, но ионные соединения абстрактны и не являются really. So … Необходимо более точно и научно, методологически рассматривать звуковое поле Ионная поляризация, а не ковалентные связи.
Смотрите также:
| Валентность и МВС | Направленность ковалентной связи |
| Насыщаемость ковалентной связи | Кратность химической связи |
