Оглавление:
В молекулярной физике рассматривается движение огромного количества мельчайших частиц вещества — атомов и молекул — которое подчиняется статистическим законам, когда рассматривают не движение отдельной частицы, а их всех в совокупности.
Молекулярно-кинетической теорией называют учение о том, что все вещества состоят из молекул и атомов, которые находятся в вечном хаотическом движении.
Атомом называется наименьшая частица химического элемента.
Молекулой называется наименьшая электрически нейтральная частица вещества, сохраняющая его химические свойства.
Основные положения молекулярной физики
- все вещества состоят из молекул и атомов;
- молекулы и атомы всех веществ находятся в вечном хаотическом движении;
- между молекулами и атомами всех веществ действуют силы притяжения и отталкивания, имеющие электромагнитное происхождение.
Доказательствами основных положений этой теории служат броуновское движение и диффузия веществ.
Броуновское движение — это движение малых частиц в жидкости под ударами ее молекул.
Диффузия — это проникновение молекул одного вещества между молекулами другого вещества.
Диффузия наблюдается у всех веществ: твердых, жидких и газообразных. Скорость диффузии зависит от агрегатного состояния вещества, от самого вещества и от температуры.
Первое экспериментальное определение скорости молекул было сделано в 1920 г. немецким физиком О. Штерном.
Между молекулами всех веществ действуют силы притяжения и отталкивания, имеющие электромагнитное происхождение. Это связано с тем, что в атомах веществ, из которых состоят молекулы, имеются заряды обоих знаков, которые по-разному взаимодействуют друг с другом. Одноименно заряженные частицы атомов отталкиваются друг от друга и одновременно разноименно заряженные частицы притягиваются друг к другу. Однако это взаимодействие всегда убывает с увеличением расстояния между молекулами и возрастает с его уменьшением.
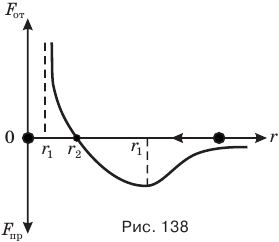
Рассмотрим график зависимости сил притяжения 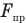 и отталкивания
и отталкивания 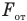 двух молекул от расстояния r между ними (рис. 138). Поместим одну молекулу в начало координат — точку О, а другую будем приближать к первой вдоль оси Or, уменьшая расстояние r между ними. Расчеты показывают, что сила притяжения обратно пропорциональна 7-й степени расстояния r, а сила отталкивания — 14-й степени этого расстояния, поэтому на больших расстояниях между молекулами преобладают силы притяжения, а на меньших — силы отталкивания.
двух молекул от расстояния r между ними (рис. 138). Поместим одну молекулу в начало координат — точку О, а другую будем приближать к первой вдоль оси Or, уменьшая расстояние r между ними. Расчеты показывают, что сила притяжения обратно пропорциональна 7-й степени расстояния r, а сила отталкивания — 14-й степени этого расстояния, поэтому на больших расстояниях между молекулами преобладают силы притяжения, а на меньших — силы отталкивания.
С уменьшением расстояния г возрастают обе силы, как притяжения, так и отталкивания. Однако на разных расстояниях скорость их увеличения различна. Когда расстояние r между молекулами велико, т.е. во много раз больше их размеров, сила притяжения с уменьшением расстояния r растет быстрее силы отталкивания, поэтому равнодействующая этих сил, изображенная на рисунке сплошной кривой, растет вначале в сторону силы притяжения и достигает максимума на расстоянии 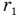 между молекулами. На этом расстоянии ускорение, с которым молекулы устремляются друг к другу, максимально.
между молекулами. На этом расстоянии ускорение, с которым молекулы устремляются друг к другу, максимально.
При дальнейшем сближении молекул равнодействующая их сил притяжения и отталкивания быстро убывает и обращается в нуль на расстоянии 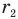 , примерно равном двум-трем диаметрам молекул. На этом расстоянии сила отталкивания равна силе притяжения.
, примерно равном двум-трем диаметрам молекул. На этом расстоянии сила отталкивания равна силе притяжения.
Если молекулы сближать дальше, сила отталкивания возрастает значительно быстрее силы притяжения, поэтому равнодействующая этих сил растет теперь в сторону силы отталкивания, стремясь к бесконечности при стремлении расстояния r между молекулами к нулю.
Если вверх от оси Or отложить потенциальную энергию взаимодействия молекул, точнее, их отталкивания, а вниз -кинетическую энергию их сближения, то график изменения кинетической и потенциальной энергий взаимодействия двух молекул будет подобен графику, изображенному на рис. 138. На расстоянии 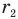 энергия межмолекулярного взаимодействия равна максимальной кинетической энергии притяжения молекул, а на расстояниях
энергия межмолекулярного взаимодействия равна максимальной кинетической энергии притяжения молекул, а на расстояниях 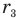 максимальна потенциальная энергия их отталкивания. На расстояниях r, превосходящих
максимальна потенциальная энергия их отталкивания. На расстояниях r, превосходящих 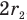 , энергия взаимодействия молекул практически равна нулю, что соответствует газообразному состоянию вещества.
, энергия взаимодействия молекул практически равна нулю, что соответствует газообразному состоянию вещества.
Молекулярная физика, описывая состояние вещества, оперирует макро- и микропараметрами. К макропараметрам состояния вещества относят его массу, давление, объем и температуру. К микропараметрам — массу отдельной молекулы, ее скорость, размеры, импульс, энергию.
Относительная молекулярная масса 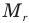 — это отношение массы молекулы
— это отношение массы молекулы 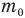 к одной двенадцатой массы атома углерода
к одной двенадцатой массы атома углерода 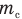 :
:
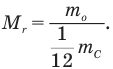
Относительная молекулярная масса — безразмерная величина.
Моль — это количество вещества, в котором содержится столько же молекул, сколько их в 12 г углерода. Единица количества вещества в СИ — моль. Моль — основная единица СИ. Объем одного моля равен отношению массы моля (молярной массы) к плотности вещества:
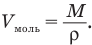
Молярной массой М называется масса одного моля. Молярная масса равна отношению массы тела к количеству вещества (количеству молей) в нем:
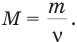
Единица молярной массы в СИ —  .
.
Число Авогдаро 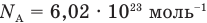 показывает, что в одном моле любого вещества содержится
показывает, что в одном моле любого вещества содержится 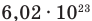 молекул.
молекул.
Закон Авогадро
Закон Авогадро: в равных объемах различных газов при одинаковых условиях всегда содержится одинаковое число молекул.
Для определения массы молекулы 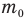 можно массу одного моля какого-нибудь вещества, т.е. его молярную массу М, разделить на число молекул в одном моле, т.е. на число Авогадро
можно массу одного моля какого-нибудь вещества, т.е. его молярную массу М, разделить на число молекул в одном моле, т.е. на число Авогадро 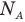 :
:
Массу одной молекулы 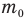 можно определить и другими способами, например, разделив всю массу вещества m на число молекул N в нем:
можно определить и другими способами, например, разделив всю массу вещества m на число молекул N в нем:
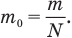
Кроме того, массу одной молекулы 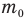 можно определить, разделив плотность вещества
можно определить, разделив плотность вещества 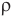 , т.е. массу единицы объема этого вещества, на концентрацию его молекул n, т.е. на их число в единице объема:
, т.е. массу единицы объема этого вещества, на концентрацию его молекул n, т.е. на их число в единице объема:
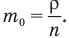
Число молекул N в данной массе вещества или в данном объеме равно произведению числа молекул в одном моле, т.е. числа Авогадро 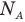 , на число молей v в веществе:
, на число молей v в веществе:
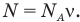
Число молекул N равно отношению массы вещества т к массе одной молекулы 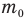 :
:
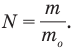
Число молекул N равно произведению числа молекул в единице объема вещества, т.е. их концентрации n, на объем вещества V:
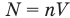
Температура — это мера средней кинетической энергии теплового движения молекул.
В международной системе единиц СИ за единицу температуры принят кельвин (К). Это одна из основных единиц СИ.
Один кельвин — это цена деления температурной шкалы, в которой за начало отсчета принят абсолютный нуль или О К.
Абсолютный нуль — это температура, при которой прекращается тепловое движение молекул.
Абсолютный нуль — это нижний температурный предел. Верхнего температурного предела не существует.
Английский ученый Кельвин предложил температурную шкалу, на которой за начало отсчета принят абсолютный нуль. Эта шкала была названа абсолютной шкалой температур, или шкалой Кельвина, а температура, измеренная по этой шкале, получила название абсолютной температуры и обозначается буквой Т. Шкала Кельвина не имеет отрицательных температур, потому что температуры ниже О К не существует, она не имеет физического смысла.
В быту для измерения температуры пользуются шкалой, Цельсия. На этой шкале за начало отсчета принят О °C — температура, при которой тает лед. Температуру, измеренную по шкале Цельсия, обозначают t °C.
Шкала Цельсия имеет как положительные, так и отрицательные значения температуры.
Между шкалами Цельсия и Кельвина существует следующая связь:
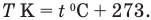
Из этого равенства следует, что
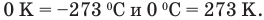
Цена деления на шкале Кельвина такая же, как и цена деления на шкале Цельсия.
Изменение температуры на обеих шкалах одинаково:
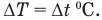
Большинство законов молекулярно-кинетической теории описывает процессы в идеальном газе.
Идеальный газ — это абстрактный газ, молекулы которого являются материальными точками и не взаимодействуют на расстоянии.
Близким к идеальному является газ под низким давлением и при высокой температуре. Воздух при нормальных условиях 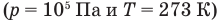 можно считать идеальным газом.
можно считать идеальным газом.
Главным уравнением молекулярно-кинетической теории является основное уравнение кинетической теории идеального газа
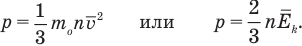
Если в сосуде имеется смесь газов, то по закону Дальтона давление смеси газов равно сумме давлений каждого газа в отдельности:
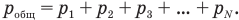
При этом каждый газ смеси занимает объем, равный объему сосуда, и при тепловом равновесии температура всех газов смеси одинакова. Общая масса газа равна сумме масс каждого газа в отдельности и общее число молей  тоже равно сумме числа молей каждого газа, а также общее число молекул равно сумме числа молекул каждого газа. Но общую молярную массу
тоже равно сумме числа молей каждого газа, а также общее число молекул равно сумме числа молекул каждого газа. Но общую молярную массу 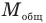 находить, просто складывая молярные массы каждого газа, нельзя, ее можно найти из одного из уравнений Менделеева — Клапейрона, записанного для смеси газов.
находить, просто складывая молярные массы каждого газа, нельзя, ее можно найти из одного из уравнений Менделеева — Клапейрона, записанного для смеси газов.
Физический смысл абсолютной температуры раскрывает формула
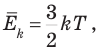
согласно которой средняя кинетическая энергия молекул идеального газа прямо пропорциональна его абсолютной температуре. Здесь 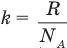 — постоянная Больцмана, R — молярная (универсальная) газовая постоянная.
— постоянная Больцмана, R — молярная (универсальная) газовая постоянная.
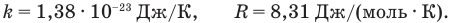
Давление идеального газа р прямо пропорционально концентрации этого газа n и его абсолютной температуре Т:
Процесс, происходящий в газе, при котором один из параметров состояния газа остается неизменным, называется изопроцессом. К изопроцессам относятся изотермический, изобарный и изохорный процессы.
Изотермическим называют процесс, протекающий при постоянной температуре. Такой процесс подчиняется закону Бойля — Мариотта.
Закон Бойля — Мариотта
Закон Бойля — Мариотта: при постоянной температуре произведение давления данной массы идеального газа и его объема есть величина постоянная:
при 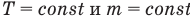
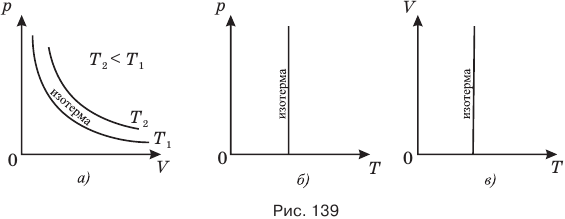
Ниже приведены графики изотермического процесса в разных координатных осях (рис. 139).
А А А
\ Т2<Т’ — —
§ I
На рис. 139, а) изотерма, соответствующая меньшей температуре 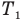 , лежит ниже и ближе к осям координат, чем изотерма, соответствующая большей температуре
, лежит ниже и ближе к осям координат, чем изотерма, соответствующая большей температуре 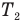 . Это связано с тем, что при одинаковом объеме большей температуре соответствует большее давление. Поскольку при этом процессе температура не меняется, то в координатах р-Т (рис. 139, б) и р-Т (рис. 139, в) изотермы представляют собой прямые линии, параллельные оси ординат.
. Это связано с тем, что при одинаковом объеме большей температуре соответствует большее давление. Поскольку при этом процессе температура не меняется, то в координатах р-Т (рис. 139, б) и р-Т (рис. 139, в) изотермы представляют собой прямые линии, параллельные оси ординат.
Реальный процесс в реальном газе можно считать изотермическим, если он протекает очень медленно, столь медленно, что изменением температуры газа за некоторый малый промежуток времени можно пренебречь.
Изобарным процессом называют процесс, протекающий под постоянным давлением.
Изобарный процесс подчиняется закону Гей-Люссака.
Закон Гей-Люссака
Закон Гей-Люссака: при постоянном давлении объем данной массы идеального газа прямо пропорционален его абсолютной температуре:
при 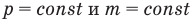
Ниже приведены графики изобарного процесса в разных координатных осях (рис. 140).
Изобарным является процесс, протекающий в газе так, что газ может свободно расширяться. Поэтому если сказано, что газ свободно изменял свой объем и при этом внешние силы, оказывающие на него давление, остались прежними, значит, в нем протекал изобарный процесс.
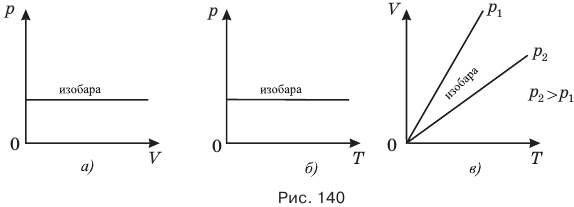
Изобары, соответствующие разным давлениям одной и той же массы идеального газа на одном графике в координатах V-T выходят из одной и той же точки — начала координат, поэтому они не могут быть параллельными друг другу. На рис. 140, в) изобара, соответствующая более высокому давлению 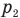 , лежит ниже изобары, соответствующей меньшему давлению
, лежит ниже изобары, соответствующей меньшему давлению 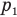 так как при неизменной температуре большему давлению соответствует меньший объем газа.
так как при неизменной температуре большему давлению соответствует меньший объем газа.
Изохорным называют процесс, протекающий при постоянном объеме. Изохорным является процесс нагревания или охлаждения газа, находящегося в закрытом сосуде.
Изохорный процесс подчиняется закону Шарля.
Закон Шарля
Закон Шарля: при постоянном объеме давление данной массы идеального газа прямо пропорционально его абсолютной температуре:
при 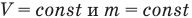
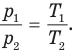
Ниже приведены графики изохорного процесса в разных координатных осях (рис. 141).
На рис. 141,6) изохоры, соответствующие разным объемам, выходят из начала координат — точки 0, поэтому они не могут быть параллельными друг другу. При абсолютном нуле, согласно закону Шарля, объем газа тоже должен стать равным нулю, что невозможно, ибо тогда молекулы расположатся вплотную друг к другу и не смогут двигаться. Но их движение вечно и неуничтожимо. Кроме того, изохора, соответствующая большему объему  , лежит ниже изохоры, соответствующей меньшему объему
, лежит ниже изохоры, соответствующей меньшему объему  , так как при неизменной температуре большему давлению соответствует меньший объем газа согласно закону Бойля-Мариотта.
, так как при неизменной температуре большему давлению соответствует меньший объем газа согласно закону Бойля-Мариотта.
Если изменяются все три параметра состояния газа — и давление, и объем, и температура, но масса остается неизменной, можно применить уравнение состояния идеального газа или уравнение Клапейрона: произведение давления данной массы идеального газа и его объема, деленное на абсолютную температуру, есть величина постоянная:
при 
Наиболее общим уравнением состояния идеального газа является уравнение Менделеева — Клапейрона. Ниже оно записано применительно к массе газа m, числу молей v и одного моля:
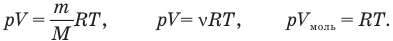
К конденсированным состояниям относят парообразное, жидкое и твердое состояния вещества.
Парообразованием называют процесс перехода вещества из жидкого состояния в газообразное. Обратный процесс называют конденсацией. Парообразование делят на испарение и кипение.
Испарение — это процесс парообразования, происходящий с открытой поверхности жидкости и при любой температуре.
Скорость испарения зависит от самой жидкости и увеличивается с увеличением ее температуры, площади открытой поверхности и скорости движения жидкости относительно внешней среды.
Над открытой поверхностью любой жидкости всегда имеются ее пары. Различают ненасыщенный и насыщенный пары. Ненасыщенный пар — это пар, в котором число молекул, вылетевших из жидкости, больше числа молекул, вернувшихся в нее. Ненасыщенный пар подчиняется законам идеального газа.
Давление ненасыщенного пара зависит от его объема и температуры. С ростом температуры давление ненасыщенного пара увеличивается. Оно также увеличивается при уменьшении объема ненасыщенного пара. При невысоких давлениях к ненасыщенному пару приближенно применимы газовые законы, справедливые для идеального газа.
При сжатии или охлаждении ненасыщенный пар становится насыщенным.
Насыщенный пар — это пар, в котором поддерживается динамическое равновесие между числом молекул, вылетевших из жидкости, и числом молекул, вернувшихся в нее.
Давление и плотность насыщенного пара, а также концентрация его молекул максимальны при данной температуре и не зависят от его объема. При попытке уменьшить объем насыщенного пара «лишние» молекулы пара уйдут в жидкость, т.е. часть пара сконденсируется, а давление, плотность и концентрация оставшегося насыщенного пара не изменятся. Следовательно, законы идеального газа к насыщенному пару неприменимы.
Изменить давление насыщенного пара можно, изменив его температуру. При нагревании увеличится кинетическая энергия молекул пара, усилятся их удары о стенки сосуда, что приведет к повышению давления. При этом нарушится динамическое равновесие между жидкостью и паром, так как благодаря возросшей кинетической энергии число молекул, покидающих жидкость, превысит число молекул, возвращающихся в нее из пара. Следовательно, при нагревании насыщенный пар становится ненасыщенным. И, наоборот, при охлаждении ненасыщенный пар становится насыщенным, так как при этом кинетическая энергия молекул пара уменьшается, скорость падает и легче происходит их переход в жидкость.
Скорость испарения зависит от рода жидкости, площади открытой поверхности, температуры и относительной скорости движения жидкости и среды.
Кипение — это процесс парообразования, происходящий не только с открытой поверхности, но и внутри жидкости, при строго определенной для данной жидкости температуре.
Каждая жидкость кипит при определенной температуре, которая называется температурой (или точкой) кипения. При кипении выполняются следующие законы:
а) температура кипения данной жидкости равна температуре ее конденсации;
б) энергия, поглощенная данной массой жидкости, нагретой до точки кипения, при полном превращении ее в пар, равна энергии, выделяемой этой же массой жидкости при конденсации;
в) время кипения данной массы жидкости равно времени ее конденсации.
Температура кипения зависит от рода жидкости и давления внешней среды. При повышении давления температура кипения увеличивается — и наоборот.
Плотность водяного пара в воздухе называется его абсолютной влажностью. Отношение абсолютной влажности воздуха при данной температуре 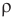 к плотности насыщенного пара при той же температуре
к плотности насыщенного пара при той же температуре 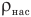 называется его относительной влажностью
называется его относительной влажностью 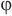 :
:
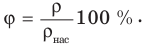
Относительной влажностью также называют отношение давления ненасыщенного пара в воздухе р при некоторой температуре к давлению насыщенного пара 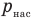 при той же температуре:
при той же температуре:
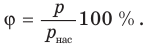
Относительную влажность обычно измеряют в процентах. Влажность воздуха не может быть выше 100% .
Если температуру воздуха, в котором содержится насыщенный водяной пар, понизить, то плотность насыщенного пара в нем станет меньше вследствие конденсации насыщенного пара.
Если воздух, в котором содержится насыщенный водяной пар, нагреть, то пар перестанет быть насыщенным, хотя плотность водяного пара в нем не изменится. При этом относительная влажность воздуха уменьшится, т.е. воздух станет суше. Для человека считается нормальной относительная влажность 50-60 %.
Температуру, при которой водяной пар становится насыщенным, называют точкой росы, потому что если водяной пар охладить до температуры ниже точки росы, то выпадет роса.
Если ненасыщенный пар находится в закрытом сосуде, то при его нагревании абсолютная влажность не меняется, а относительная уменьшается, — и наоборот. А если его охлаждать, то она сначала превратится в насыщенный пар, а затем сконденсируется.
Приборы для измерения влажности воздуха называются гигрометрами или психрометрами.
Рассмотрим принцип работы психрометра Августа, изображенного на рис. 142. Он состоит из двух термометров, укрепленных на вертикальном штативе.

Один термометр сухой, а другой влажный, потому что его конец обернут ватой или марлей, нижний конец которой опущен в открытый сосуд с жидкостью (водой или спиртом).
Когда воздух сухой, вода испаряется с марли, вследствие чего ее внутренняя энергия уменьшается, ведь воду покидают молекулы с наибольшей кинетической энергией — самые «быстрые». С уменьшением внутренней энергии марли ее температура понижается, поэтому влажный термометр показывает более низкую температуру, чем сухой.
Чем суше воздух, тем интенсивнее происходит процесс испарения воды с марли и тем больше разность в показаниях сухого и влажного термометров, которую называют психрометрической разностью температур. И наоборот, чем воздух влажнее, тем эта разность меньше, так как процесс испарения влаги с марли протекает менее интенсивно.
Таким образом, по психрометрической разности температур можно судить о влажности воздуха.
Твердые тела делят на кристаллические и аморфные.
Кристаллическими называют вещества, у которых атомы или молекулы расположены в определенном порядке, образуя кристаллическую решетку, где наблюдается повторяемость в их расположении. Основное свойство кристаллических веществ — анизотропия, т.е. различие их физических свойств в разных направлениях. К кристаллическим веществам относятся металлы, глина, кремний, поваренная соль, лед и другие вещества.
Аморфными называют тела, в которых отсутствует упорядоченность в расположении атомов и молекул. Их основное свойство — изотропия, т.е. одинаковость физических свойств в разных направлениях. К аморфным веществам относятся сахар, стекло, каучук, пластмассы и другие вещества.
Процессы плавления и отвердевания у кристаллических и аморфных веществ происходят различно.
Плавлением называют процесс перехода твердого вещества в жидкое состояние. Обратный процесс у кристаллических веществ называется кристаллизацией, а у аморфных — отвердеванием.
Рассмотрим процесс изменения температуры Т с течением времени t при переходе твердого кристаллического вещества через жидкую фазу в газообразную и наоборот (рис. 143). При нагревании твердое тело получает тепловую энергию от нагревателя. При этом увеличиваются средняя кинетическая и средняя потенциальная энергии его молекул (участок 1-2 графика) и происходит повышение температуры. Участок 1-2 соответствует только твердому состоянию.
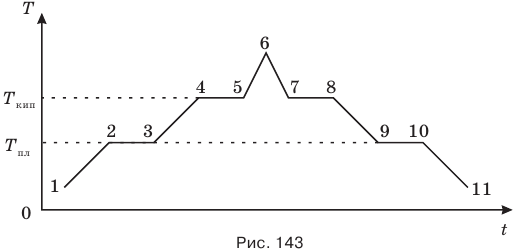
При достижении температуры плавления Тпл (точка 2 графика) начинается процесс разрушения кристаллических решеток, т.е. плавление (участок 2-3). В процессе плавления увеличивается только средняя потенциальная энергия молекул, а их средняя кинетическая энергия и связанная с ней температура остаются неизменными. Участок 2-3 соответствует и твердому, и жидкому состояниям. Точка 3 соответствует окончанию процесса перехода твердого вещества в жидкое, т.е. в этот момент времени все вещество становится жидким.
При дальнейшей передаче тепла происходит нагревание жидкости (участок 3-4). При этом увеличиваются средние кинетическая и потенциальная энергии молекул и температура жидкости растет. Участок 3-4 соответствует только жидкому состоянию. Точка 4 соответствует началу процесса кипения, т.е. достижению температуры кипения 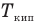 . При дальнейшей передаче тепла происходит процесс кипения (участок 4-5). В этом процессе увеличивается только средняя потенциальная энергия молекул, а их средняя кинетическая энергия не меняется и связанная с ней температура тоже остается постоянной. Участок 4-5 соответствует и жидкому, и газообразному состояниям. Точка 5 соответствует полному переходу всей жидкости в пар.
. При дальнейшей передаче тепла происходит процесс кипения (участок 4-5). В этом процессе увеличивается только средняя потенциальная энергия молекул, а их средняя кинетическая энергия не меняется и связанная с ней температура тоже остается постоянной. Участок 4-5 соответствует и жидкому, и газообразному состояниям. Точка 5 соответствует полному переходу всей жидкости в пар.
При дальнейшей передаче тепла происходит нагревание пара (участок 5-6). Здесь снова увеличиваются средние кинетическая и потенциальная энергии молекул, и температура пара растет. Участок 5-6 соответствует только газообразному состоянию.
Теперь рассмотрим обратный процесс перехода из газообразного в твердое кристаллическое вещество. Если в момент, соответствующий точке 6, убрать источник тепловой энергии, то начнется процесс охлаждения пара, при котором средние кинетическая и потенциальная энергии его молекул станут уменьшаться и температура пара — понижаться (участок 6-7). При этом выделится тепловая энергия, поглощенная в процессе нагревания пара. Участку 6-7 соответствует только пар (газ). Точка 7 соответствует началу процесса конденсации пара, т.е. перехода его в жидкость.
Участок 7-8 соответствует процессу конденсации пара, когда уменьшается только средняя потенциальная энергия молекул, а их средняя кинетическая энергия и температура вещества остаются постоянными. При этом выделяется тепловая энергия, поглощенная при кипении. Здесь имеют место и жидкая, и газообразная фазы. Точка 8 соответствует полному переходу пара в жидкость.
Участок 8-9 соответствует охлаждению жидкости, когда уменьшаются средние кинетическая и потенциальная энергии молекул и температура жидкости понижается. При этом выделяется тепловая энергия, полученная при нагревании жидкости. Точка 9 соответствует началу кристаллизации.
Участок 9-10 соответствует кристаллизации, т.е. процессу восстановления кристаллических решеток. При этом уменьшается только средняя потенциальная энергия молекул, а их средняя кинетическая энергия и температура вещества остаются постоянными. Здесь выделяется тепло, поглощенное при плавлении. Здесь и жидкое, и твердое состояния. Точка 10 соответствует полному восстановлению кристаллических решеток, т.е. превращению жидкого вещества в твердое.
Участок 10-11 соответствует процессу охлаждения только твердого вещества, когда уменьшаются средние потенциальная и кинетическая энергии молекул и температура понижается.
При этом выделяется тепло, поглощенное при нагревании твердого вещества.
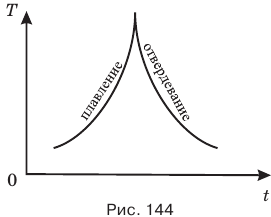
Аморфные вещества не имеют точек плавления и кристаллизации и на соответствующем графике горизонтальные участки 2-3 и 9-10 у них отсутствуют (рис. 144).
В процессе передачи тепла аморфному веществу оно становится все мягче и мягче, пока совсем не превратится в жидкость. При отдаче тепла аморфное вещество тоже постепенно твердеет, пока совсем не станет твердым, поэтому аморфные вещества иногда называют застывшими жидкостями.
Эта теория со страницы подробного решения задач по физике, там расположена теория и подробное решения задач по всем темам физики:
Возможно вам будут полезны эти страницы:
| Статика в физике: основные формулы, определения и примеры |
| Гидромеханика в физике: основные формулы, определение и примеры |
| Молекулярная физика основные формулы |
| Термодинамика в физике: основные формулы |
