В термодинамике рассматривают процессы перехода тепловой энергии от одних тел к другим. Каждое тело обладает своей внутренней энергией.
Внутренней энергией называется сумма кинетических и потенциальных энергий всех молекул тела.
Так как у молекул идеального газа нет потенциальной энергии взаимодействия, то внутренней энергией идеального газа называется сумма только кинетических энергий его молекул.
Внутренняя энергия идеального одноатомного газа определяется формулой
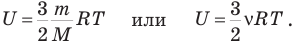
Изменить внутреннюю энергию можно двумя путями: путем совершения работы и путем теплопередачи.
Теплопередачей называют передачу тепла от одного тела другому без совершения механической работы или без превращения тепловой энергии в иные виды.
Теплопередачу делят на теплопроводность, конвекцию и излучение.
Теплопроводность — это передача тепла от горячего тела холодному при их соприкосновении.
Конвекция — это передача тепла путем взаимного перемещения теплых и холодных слоев жидкости и газа.
Излучение — это передача тепла с помощью электромагнитных волн.
При теплопередаче тела передают друг другу количество теплоты.
Количество теплоты Q — это мера изменения внутренней энергии тела, происшедшего без совершения механической работы.
Количество теплоты — скалярная величина. Единица измерения ее в СИ — джоуль (Дж).
При нагревании, плавлении и парообразовании тело получает извне количество теплоты, а при охлаждении, кристаллизации и конденсации выделяет его во внешнюю среду. Для характеристики способности вещества поглощать теплоту при нагревании, плавлении или парообразовании и выделять ее при охлаждении, кристаллизации и конденсации, а также при сгорании, введены понятия удельной теплоемкости с, удельной теплоты плавления 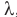 , удельной теплоты парообразования r (или L) и удельной теплоты сгорания q.
, удельной теплоты парообразования r (или L) и удельной теплоты сгорания q.
Удельная теплоемкость с — это величина, равная отношению количества теплоты, полученного при нагревании тела или выделенного при его охлаждении, к массе этого тела и изменению его температуры:
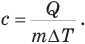
Удельная теплоемкость — скалярная величина. Ее единица в СИ — Дж/(кг- К). Удельная теплоемкость разных твердых и жидких веществ приведена в справочной литературе.
Иногда в условии задачи речь идет не об удельной теплоемкости вещества, а о теплоемкости тела С. Это другая величина.
Теплоемкость тела — это величина, равная отношению количества теплоты Q, поглощенной телом при нагревании, к изменению его температуры 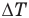 :
:
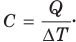
Единица теплоемкости тела в СИ — Дж/К.
Теплоемкость тела равна произведению удельной теплоемкости на массу тела:
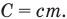
Зная удельную теплоемкость или теплоемкость тела, можно определить количество теплоты, которое поглотится при нагревании или выделится при охлаждении данной массы тела на известную разность температур по формулам:
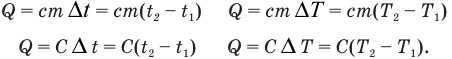
Удельная теплота плавления 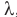 — это величина, равная отношению количества теплоты, полученного при плавлении тела или выделенного при его кристаллизации, к массе тела:
— это величина, равная отношению количества теплоты, полученного при плавлении тела или выделенного при его кристаллизации, к массе тела:
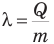
Удельная теплота плавления кристаллического вещества — скалярная положительная величина. Ее единица в СИ — Дж/кг.
Удельная теплота плавления данного вещества равна удельной теплоте его кристаллизации. Определив по справочнику удельную теплоту плавления данного кристаллического вещества, можно вычислить количество теплоты, требуемое для того, чтобы расплавить некоторую массу этого вещества при температуре его плавления по формуле:
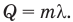
Следует знать, что вода и лед могут находиться в тепловом равновесии, когда лед не тает, а вода не замерзает, при О °C.
Пока лед не нагреется до О °C, он таять не начнет. Так и вода, пока не охладится до О °C, не начнет превращаться в лед.
Удельная теплота парообразования r (или L) — это величина, равная отношению количества теплоты, полученной при парообразовании или выделенной при конденсации, к массе вещества:
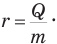
Удельная теплота парообразования — скалярная величина. Единица удельной теплоты парообразования в СИ — Дж/кг.
Удельная теплота парообразования данной жидкости равна ее удельной теплоте конденсации. Ее величину можно найти для каждой жидкости в справочной литературе. Зная удельную теплоту парообразования данной жидкости и ее массу, можно определить количество теплоты, которое поглотит эта жидкость при полном превращении ее в пар в процессе кипения, по формуле
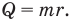
Температура кипения воды при нормальном атмосферном давлении 100 °C — и при этих условиях до более высокой температуры воду нагреть нельзя.
Удельная теплота сгорания q — это величина, равная отношению количества теплоты, выделившегося при сгорании вещества, к его массе:
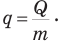
Удельная теплота сгорания — скалярная величина. Ее единица в СИ — Дж/кг. Удельную теплоту сгорания данного топлива можно найти в справочной литературе.
Зная удельную теплоту сгорания топлива и его массу, можно определить количество теплоты, которое выделится при его полном сгорании, по формуле:
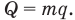
Работа А при изобарном изменении объема газа равна произведению давления газа р на изменение его объема 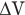 :
:
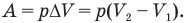
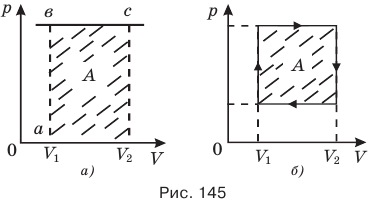
Графически в координатных осях p-V (рис. 145, а) работа А изобарного расширения газа от объема 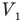 до объема
до объема 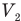 равна площади прямоугольника, одной стороной которого служит отрезок аб, численно равный давлению газа р, а другой — отрезок бc, численно равный изменению объема газа
равна площади прямоугольника, одной стороной которого служит отрезок аб, численно равный давлению газа р, а другой — отрезок бc, численно равный изменению объема газа 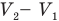 . При круговом процессе, когда термодинамическая система возвращается в исходное состояние, работа численно равна площади замкнутой фигуры, ограниченной графиком (рис. 145, б).
. При круговом процессе, когда термодинамическая система возвращается в исходное состояние, работа численно равна площади замкнутой фигуры, ограниченной графиком (рис. 145, б).
При расширении газа силы давления совершают положительную работу, увеличивая объем газа. При сжатии газа внешние силы совершают отрицательную работу, поскольку изменение объема газа в этом случае меньше нуля, ведь при сжатии конечный объем 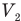 меньше начального объема
меньше начального объема 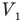 .
.
Если газ содержится в закрытом сосуде, т.е. его объем постоянный, то процесс, происходящий с ним, изохорный. При этом изменение объема газа равно нулю и, значит, работа изменения его объема тоже равна нулю:
при  .
.
Таким образом, при изохорном процессе газ работу не совершает.
В термодинамике любую группу тел или частиц называют термодинамической системой. Если термодинамической системе извне передается некоторое количество теплоты Q, то оно расходуется на изменение внутренней энергии системы 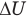 и на совершение системой работы против внешних сил А:
и на совершение системой работы против внешних сил А:
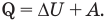
Полученное выражение получило название первого закона термодинамики (первого начала термодинамики).
Если система получает извне количество теплоты, то в этой формуле перед Q ставится плюс, если отдает его во внешнюю среду, то — минус. Если температура системы повышается, т.е. ее внутренняя энергия увеличивается, то в этой формуле перед 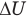 ставится плюс, если она уменьшается, то — минус. Если система расширяется, совершая работу против внешних сил, то в этой формуле перед А ставится плюс, если внешние силы сжимают систему, то — минус.
ставится плюс, если она уменьшается, то — минус. Если система расширяется, совершая работу против внешних сил, то в этой формуле перед А ставится плюс, если внешние силы сжимают систему, то — минус.
Применение первого закона термодинамики к изотермическим процессам:
- к изотермическому: при Т = const
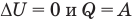
- к изохорному: при V = const
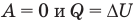
- к изобарному: при р = const
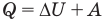
Здесь Т — абсолютная температура, 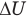 — изменение внутренней энергии, Q — количество теплоты, А — работа, V — объем, р — давление.
— изменение внутренней энергии, Q — количество теплоты, А — работа, V — объем, р — давление.
Адиабатным называется процесс, протекающий в термодинамической системе без теплообмена с внешней средой.
Поскольку при адиабатном процессе термодинамическая система не получает и не отдает тепло, то количество теплоты в формуле первого закона термодинамики равно нулю, поэтому применительно к адиабатному процессу первый закон термодинамики примет вид:
при  .
.
При адиабатном процессе изменение внутренней энергии термодинамической системы равно работе системы, взятой со знаком «минус».
При адиабатном сжатии газа его внутренняя энергия увеличивается и, согласно формуле,
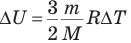
температура газа повышается, т.е. он нагревается. И наоборот, при адиабатном расширении газа его внутренняя энергия уменьшается и, согласно той же формуле, температура понижается, т.е. газ охлаждается.
На графике в координатах p-V адиабата изображается кривой, которая идет круче гиперболы — изотермы (рис. 146).
Процесс в реальном газе можно считать адиабатным, если
он протекает столь быстро, что газ не успевает обменяться теплом с внешней средой. Примером такого процесса может служить процесс истечения отработанного газа из сопла ракеты, который резко расширяется и при этом сильно охлаждается.
Некоторые формулировки второго закона термодинамики:
а) любые самопроизвольные про-
цессы в термодинамической системе, состоящей из статистически огромного числа частиц, всегда переводят эту систему из менее вероятного состояния в более вероятное и никогда наоборот;
б) невозможен самопроизвольный процесс передачи тепла от тел, менее нагретых, телам, более нагретым;
в) невозможно изготовить вечный двигатель второго рода — устройство, в котором бы все тепло, полученное от нагревателя, полностью превращалось бы в механическую работу.
Тепловые двигатели — это устройства, в которых тепловая энергия превращается в механическую.
Основными частями любого теплового двигателя являются: нагреватель, рабочее тело и холодильник. На рис. 147 изображена условная схема любого теплового двигателя.
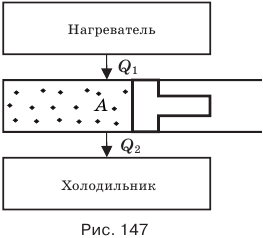
Нагреватель (паровой котел, горючая смесь, различные виды топлива) выделяет тепловую энергию, нагревая рабочее тело, которое находится в рабочей камере двигателя. Рабочим телом может быть пар или газ. Получив количество теплоты 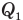 , газ расширяется, поскольку его давление
, газ расширяется, поскольку его давление 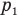 больше внешнего давления (например, атмосферного), и перемещает поршень, совершая положительную работу.
больше внешнего давления (например, атмосферного), и перемещает поршень, совершая положительную работу.
Работа А, совершенная двигателем, равна разности количества теплоты 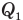 , полученной от нагревателя, и количества теплоты
, полученной от нагревателя, и количества теплоты 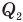 , отданной холодильнику:
, отданной холодильнику:
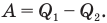
Работоспособность разных двигателей при одинаковых затратах тепловой энергии характеризуется их коэффициентом полезного действия (КПД 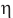 ).
).
Коэффициентом полезного действия теплового двигателя называется отношение работы, совершенной этим двигателем, к количеству теплоты, полученному от нагревателя:
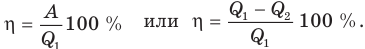
Французский инженер Сади Карно в 1824 г. вывел формулу максимального КПД идеального теплового двигателя, в котором рабочим телом являлся идеальный газ и цикл которого состоял из двух изотерм и двух адиабат — цикла Карно.
Формула КПД цикла Карно, т.е. максимального КПД теплового двигателя, имеет вид:
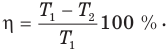
Здесь 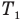 — абсолютная температура нагревателя,
— абсолютная температура нагревателя, 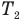 — абсолютная температура холодильника.КПД любого реального теплового двигателя всегда меньше КПД цикла Карно такой же конструкции. Анализ формулы максимального КПД позволяет наметить пути повышения КПД реальных тепловых двигателей. Для этого нужно увеличить числитель этой формулы, т.е. разность температур нагревателя и холодильника (внешней среды)
— абсолютная температура холодильника.КПД любого реального теплового двигателя всегда меньше КПД цикла Карно такой же конструкции. Анализ формулы максимального КПД позволяет наметить пути повышения КПД реальных тепловых двигателей. Для этого нужно увеличить числитель этой формулы, т.е. разность температур нагревателя и холодильника (внешней среды) 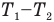 . Поскольку изменить температуру внешней среды невозможно, нужно повысить температуру нагревателя, выбирая соответствующие виды топлива. Очевидно, что КПД данного теплового двигателя при одинаковой температуре нагревателя зимой выше, чем летом, так как зимой температура внешней среды ниже. Кроме того, для повышения КПД тепловых двигателей необходимо искать пути уменьшения тепловых потерь, улучшая теплоизоляцию, уменьшая трение в узлах двигателя и потери энергии из-за неполного сгорания топлива, улучшая конструкцию двигателей, и т. п. Повышение КПД тепловых двигателей — важная техническая задача.
. Поскольку изменить температуру внешней среды невозможно, нужно повысить температуру нагревателя, выбирая соответствующие виды топлива. Очевидно, что КПД данного теплового двигателя при одинаковой температуре нагревателя зимой выше, чем летом, так как зимой температура внешней среды ниже. Кроме того, для повышения КПД тепловых двигателей необходимо искать пути уменьшения тепловых потерь, улучшая теплоизоляцию, уменьшая трение в узлах двигателя и потери энергии из-за неполного сгорания топлива, улучшая конструкцию двигателей, и т. п. Повышение КПД тепловых двигателей — важная техническая задача.
Эта теория со страницы подробного решения задач по физике, там расположена теория и подробное решения задач по всем темам физики:
Возможно вам будут полезны эти страницы:
| Молекулярная физика основные понятия, законы и определения |
| Молекулярная физика основные формулы |
| Электромагнетизм в физике: основные формулы |
| Электростатика основные понятия, законы и формулы |
