Оглавление:


Общие представления о скорости химических реакций
- Общее представление о скорости химической реакции. один Основная концепция химической кинетики — скорость Реакция. С т р а н и ц а ш м е н с к и й Изменить количество реагентов на единицу Время на единицу пространства реакции. однородная Реакционная космическая система Взаимодействие торового потока.
- Реакция протекает с разной скоростью. Один из Они пройдут быстро, другие — очень медленно, некоторые начнут Замедляйтесь после того, как становитесь жестокими, другие едва Правильно и ускоренно. Скорость реакции определяется Прежде всего, в зависимости от природы реагирующего вещества. Но реакция Почти нулевая скорость при комнатной температуре.
Это может протечь, как только это нагрето. Людмила Фирмаль
Ускорить резко Каталитическое взаимодействие. Химическая скорость Реакция зависит от условий процесса. Поэтому скорость равномерной химической реакции измеряется Изменение концентрации одного из родственных зверей Процесс за единицу времени. Концентрация С составляет моль / л, а время i-min или s, таким образом, измерение скорости Реакция моль / (л * мин) или моль / (л * с).
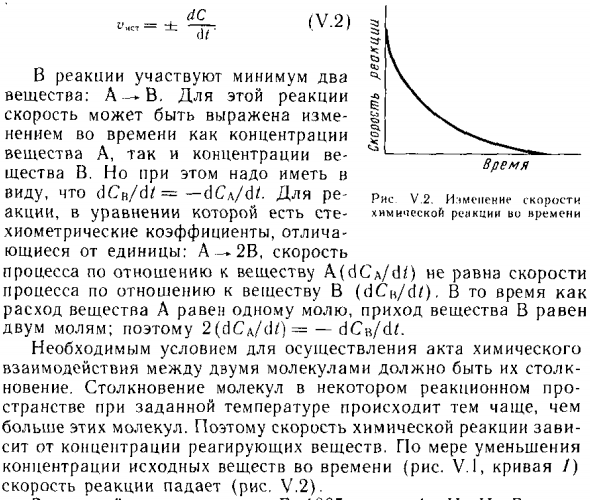
В химических взаимодействиях Влияние концентрации каждого исходного материала снижается По времени (СгСС; .ЛСССО) и концентрации каждого Продукт реакции увеличивается (C 2> C i; L C> 0). изменение Концентрация исходного материала и Продукты реакции с течением времени V .l показано на рисунке.
Различают по химической кинетике Средний и истинный (или мгновенный) Скорость реакции. Средняя скорость V равно отношению AC / Al (LS = = C 2 -C \ D / = / 2- / |). Замечательно Всегда позитивен в скорости Ной, префикс дроби со знаком «+»: Я время Рисунок v.l. Изменение концентрации Химическая тяга Peaft’KTOB Физическое взаимодействие; / • Изменить! concsmsggracin Статус источника;
- 2 информация Концентрация продукта реакция переменный ток F- (V. Истинная пропорция химических веществ Запас y „, t определяется ограничениями, Найти соотношение AC / A1 В л? О, это дифференциальная концентрация Время тяги; ус (] 1 (Д.2) U.2 и Ri замедление Химическая реакция с течением времени По крайней мере два человека участвуют в реакции.
Вещество; А-Б. Об этой реакции Экспресс скорость По времени как концентрация Вещество A и концентрация ve б, но один (\ Ck / b1 = -i \ C ^ / 6í. Запасы в уравнении Kymetric коэффициент, отлично Изменяется от 1; A- * 2B. скорость.
Процесс для вещества A (c1Cd / (10 не равно скорости Процессы, связанные с веществом B ((1Сц / с10. Людмила Фирмаль
Расход вещества А равен 1 моль, а поступление вещества В составляет 2 моль: следовательно, 2 (s1Sl / (] 0 = -s) Зв / с1 ^ Предпосылки для осуществления химических действий Взаимодействие между двумя молекулами должно быть их столкновением Обновления, молекулярные столкновения в определенных реакциях.
Блуждающий при данной температуре происходит чаще Многие из этих молекул. Следовательно, скорость химической реакции Сито от концентрации реагентов. По мере уменьшения Концентрация исходного материала во времени (Рисунок V,!, Кривая /) Скорость реакции уменьшается (рис, Y, 2),
Смотрите также:
| Направление и пределы самопроизвольного течения химических реакций | Закон действующих масс |
| Константа равновесия | Кинетическая классификация реакций |
Если вам потребуется помощь по химии вы всегда можете написать мне в whatsapp.
