Оглавление:




Однокомпонентные системы
- В этом деле с = 1, Р ’= 0、 Правило фазы может принимать следующую форму: а) если система состоит только из 1 фазы (пара, жидкости или твердого вещества), Φ= 1 и w =2.Такая система может быть оснащена 2 вариантами 1 ГНБС [231, 96 страниц. П. а. ДУЭМ. Ж. Физ. Шеню 2, 1, 91 (1898); де-не-де [5], стр. 125: Жуге.
Смотрите также ее. Полит., 2-я серия, 21, 62(1921); С. Т. Боввден. Фазовые правила и фазовые реакции(Лондон, 1945). 2 поскольку полный молекулярный состав обычно неизвестен, следует иметь в виду, что количество компонентов системы и количество протекающих в ней реакций являются в некоторой степени условными характеристиками.
То есть могут существовать свободные радикалы H и OH, ионы OH и др. в водяном паре и так далее, но это не приводит к изменению формы фазового правила(13.5). Людмила Фирмаль
Н20 Н-О、 Количество компонента c увеличивается на 2, но в то же время увеличивается число на реакцию/единицу, и отображаются дополнительные условия ЛГ = xoiu То есть изменчивость системы w не изменяется. {Примечание под ред.)
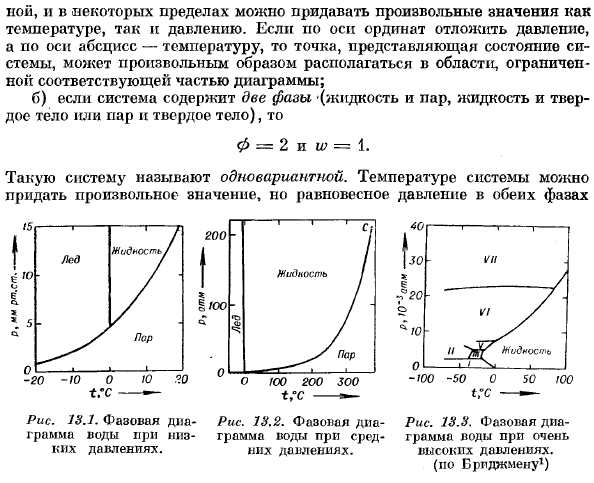
- Любое значение может быть присвоено как температуре, так и давлению, как произвольно, так и в определенных пределах. когда вы устанавливаете давление на оси y и температуру на горизонтальной оси, точки, представляющие состояние системы, могут быть размещены произвольно в области, ограниченной следующей границей. Б) если система содержит 2 фазы (жидкость и пар, жидкость и твердое вещество или пар и твердое вещество)、 0 = 2 и w = 1. Такая система называется 1 вариант. Температура системы может быть любой величины, но равновесное давление обеих фаз Рисунок 13.1.Этап 2-Рисунок 13.2.Дно фазы-рисунок 13.3.
Фазовая диаграмма воды на уровне воды в умеренной воде при очень высоком давлении. Ноющее давление. Высокое давление. (Но к Браппману1) Оказывается, это функция выбранной температуры. Поэтому точка, представляющая состояние 2-фазной системы, находится на некотором line. At в каждой точке этой линии сродства перехода вещества из одной Фазы в другую равны нулю. в) когда в системе имеется 3 фазы (пар, жидкость, твердое вещество) 、 φ= 3 и w-0、 То есть система неизменна. Ни давление, ни температура не могут быть выбраны arbitrarily. In в соответствии с этим экспериментально было установлено, что равновесие между тремя состояниями вещества возможно только при строго определенных значениях температуры и давления.
Точка, в которой твердые тела, жидкости и пары входят в состояние равновесия, называется тройной точкой. Для воды, температура+ 0.0076°C и давление 4.6 mm Hg позволяют сосуществованию 3 участков. Искусство. На рисунке показана фазовая диаграмма воды при низком давлении (несколько мм рт. ст.). 13.1.Тройная точка имеет 3 кривые. Это кривые давления пара на льду, кривые давления пара на жидкой воде и почти вертикальные сосуществующие кривые льда и жидкой воды.
Это кривые давления пара на льду, кривые давления пара на жидкой воде и почти вертикальные сосуществующие кривые льда и жидкой воды. Людмила Фирмаль
На рис. 13.2 показана критическая точка ©, охватывающая диапазон давлений до ста атмосфер, но при ее превышении разница между жидкостью и паром теряется. Наконец, на рис. 13.3 показана фазовая диаграмма воды при давлении до 30 000 atm1.At очень высокие давления、 Лед в различных формах. Область существования любых 2 форм разделена линиями, где обе формы coexist. In кроме того, есть несколько тройных точек, которые соответствуют сосуществованию 3 форм льда. Например, если ice, ice III, ice V.
Смотрите также:
| Термодинамические свойства жидкостей | Двойные системы. Кривые плавления. Эвтектические точки. |
| Правило фаз Гиббса и теорема Дюгема. Правило фаз | Тройные системы |
