Оглавление:



Пероксид водорода
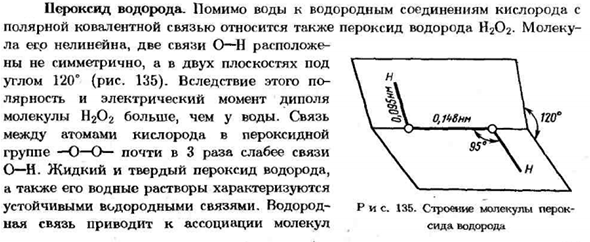
- Водород peroxide. In добавление к воде, соединениям водорода кислорода и Полярная ковалентная связь также включает перекись водорода H2O2.Марек. la esr нелинейна и имеет 2 O-H связи Они не симметричны, но в 2 плоскостях ниже Угол 120°(рис. 135).Результат、 Дипольная полярность и электрический момент Молекулы Н2О2 крупнее молекул воды.
- Общение Между атомами кислорода перекиси Группа-О-О-связи почти в 3 раза слабее O-N. Перекись водорода в жидком и твердом состоянии、 Он характеризуется так же, как и водный раствор Устойчивая водородная связь. Водород-цифра 135.Структура молекулярных пероксидов Связывание приводит к Ассоциации молекул сероводорода 120° .
Перекись водорода представляет собой вязкую легкую Н2О2 Безвкусная голубая жидкость Людмила Фирмаль
Перекись водорода почти в 1,5 раза тяжелее воды、 Его температура кипения высока, и его поверхностное натяжение больше, чем у воды. Перекись водорода получают окислением алкильного производного гидрохинона. В воздухе (80% из итога), и электролизе решения сульфата Фата аммония или sulphate. In последний случай, анион кислоты воды Когда он окисляется до пероксодисульфуровой кислоты (выше) на аноде、
Если перекись водорода получается с водой: 2HSO4-2C — = H2S2O; H2S2Og + 2H2O = 2H2SO4 + H2O2 В природе постоянно образуется небольшое количество перекиси водорода Грозовые разряды, атмосферная коррозия металлов、 Органические и неорганические вещества. Согласно теории Баха-Энглера, окисление Многие вещества протекают через стадию образования нестабильных промежуточных продуктов Перекись, ее превращение в стабильный оксид Перекись водорода часто выделяется.
Перекись водорода высокой чистоты и ее раствор для разбавления Температура в помещении очень стабильна, но в присутствии переходных ионов Металл и серебро, и разлагаются под воздействием ультрафиолета Низкий уровень кислорода. Молекулярная нестабильность H2O2 и легкость кислородной резки Да, они связаны с низкой прочностью-O-O-перекиси chain. To избегайте Разложение перекиси водорода хранится в темной бутылке в темном месте.
Для этой же цели применяют ингибиторы, например, фосфат натрия. На распродаже Раствор высокой концентрации 85-90% перекиси водорода Н2О2 содержание, и пергидроль-это 30% водный раствор Решение. Как и вода, перекись водорода хорошо растворяет многие вещества Ларри Бонд. Высокая диэлектрическая проницаемость, наличие водорода Сочетание H2O2 и его водного раствора обеспечивает отличную ионизацию Растворитель.
- В водных растворах, перекись водорода проявляет слабокислые свойства. Н2О2+Н2О=Н3О+ +НО2,рА’а= 11.65 * Как кислота H2O2 реагирует со щелочью с образованием перекисей металлов: H2O2 + Ba (OHJ = BaO2 + 2H2O BaO2-это соль перекиси водорода, а не оксида бария. Подобный. Соединения кислорода в структуре, например SnO2, PbO2, MnO2 Нет перекисной группы-O-O-это нормально Оксид, а не перекись.
Если последний взаимодействует с кислотами、 Перекись водорода, а не вода: BaO2 + H2SO4 = BaSO4 + H2O2 SnO2 + 2H2SO4 = Sn (SO4J + 2H2O Ы’ ¦ * Для удобства, вместо K (константа диссоциации), минус 10 Логарифм этой величины равен pK (аналогично pK). PJ^, ecr имеет то же значение. РПР (пр-произведение растворимости) комплексных и малорастворимых солей.
Производные перекиси водорода, пероксиды и основания( В своей химической структуре, присутсвии перекиси Цепь. Людмила Фирмаль
Формально формула Перикислоты такова、 Молекула Н2О2 для кислотных радикалов: О, да. НЕ-Е О / | / / НЕТ-О ^ О ^ О ш-0-так-так-Ч П ^ Нет^ о / | / / ой ой О, да. Монофонический дифосфат (Пероксо одна сера) (пероксо две серы) (пероксо один фосфор) Если заменить 1 атом водорода молекулы Н2О2 атомом металла, то получим: Оправдание, например, К-О-О.
Такими соединениями являются Перекись водорода считается кислой солью, и их часто называют гидро — Пероксид. Свойства пероксидов металлов, пероксидов и гидроксидов Низкие пероксиды-способность подвергаться гидролизу за счет образования пероксидов Водород и разложение, выделение кислорода, а именно окисление.
Сэм перролок Сида водорода является как окислителем, так и восстановителем. Окислитель: Н2О2+ If +2Н+ =2Н2О, Å°= +1.776 V、 Редуктор: О2 + 2Н + 2е » = Н2О2, е°= +0.682 В. Как видно из значения стандартного окислительно-восстановительного потенциала, Свойства перекиси водорода более выражены, чем восстановительные свойства.
Пероксид Водород легко окисляет йодид до свободного йода, нитрит до нитрата, хромата Пероксокулозная кислота и др.、 Реакция с сильным окислителем в кислой среде, Н2О2 уменьшена M11O4-Mn2 +. кроме того, перекись водорода подвержена реакциям диспропорционирования Деление, примером которого является процесс его разложения В присутствии света, примесей, нагрева: H262 + H262 = 62 + 2H262
Смотрите также:
| Получение водорода | Литий |
| Вода | Щелочные металлы |
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
