Оглавление:









Подгруппа хрома
- Подгруппа хрома. Элементы VIB группы периодической системы включают в себя、 Хром, молибден и вольфрам объединены. Для стабильности компонентов (P at В первых 2 элементах подгруппы、 Из оболочки ns shell (n -) d. валентный электронный состав вольфрама Перед рацией находится готовая оболочка 4/4.
- Отсюда и история его собственности Появляется эффект сокращения лантаноида. Характеристики элементов и простых веществ группы VIB: Следует отметить, что первый ионизационный потенциал Выделяются из последующего увеличения серии Cr-Mo-W(и их сумма) Первый ионизационный потенциал приводит к увеличению химического облагораживания Простое вещество при переходе от хрома к вольфраму.
Сравните некоторые характеристики ниже. Людмила Фирмаль
Второй вариант Ионизация хрома и молибдена несколько отличается, но/ 2 В вольфраме он значительно меньше. Это связано с первым электронным скольжением В результате 1% из них имеют 2 элемента, характеризующие необходимую энергию отделите радиочастотные электроны от внешнего уровня. Вольфрам имеет 2-й шанс. Ионизация соответствует разделению 6 ″ электронов.
Аналогичная модель Это наблюдается на 4-м потенциале ионизации. Напротив того.、 Высокий потенциал ионизации и всего 6 потенциалов、 В результате, вы должны ожидать большое сходство между ними Сильно окисленные элементы. Значения OEE для этих элементов следующие Относительно инертный металл. Поэтому о химии хрома и его аналогов Образование ионных соединений, главным образом、 Взаимодействие с сильным электроотрицательным элементом.
Напротив того. Ожидается большое разнообразие интерметаллических соединений. Ионность Лучший диаметр состояния окисления молибдена и вольфрама примерно одинаковый Они существенно отличаются от радиуса Cr6 +ions. It коррелирует хорошо б Схема изменения выше/ 6 и Е У и описание сходства я-Г Характеристики Mo и W в характерном состоянии окисления.
Получение природных соединений и металлов V I B rg p p s. наиболее распространенным минералом хрома является хром. Железная руда (хромит) FeO-CrgO3. 2-я по значимости хромовая руда-это хром. коит-свинцовый хромат PbCrO ^наиболее распространенный Минералов молибдена-молибденит (молибденовый блеск) Мобг-вольфрам Главным образом установлено естественно в форме вольфрамата двухвалентного металла К ним относятся, например, вольфрам-изоморфная смесь солей вольфрама
Различный состав железа и марганца Fe ^ Mni — ^ WC ^, scheige CaWC> 4, stolosite PbWC> 4 etc.、 Бенитеза. В чистом виде эти металлы получают с помощью Хромалюминотермии Водородное восстановление молибдена и вольфрама: Cr2O3 + 2A1 = 2Cg + A12O3; EO3 + ZN2 = E + ZN2O Восстановлением водорода или термическим восстановлением металла、 Порошок или губчатый металл.
Для компактного металла А дополнительную очистку обычно проводят с помощью вакуумного растворения Электронно-лучевой нагрев или плавка в электродуговой печи c потоком Водоохлаждаемый медный тигель из выдувного железного металлического электрода. Что касается потребностей сталелитейной промышленности, обычно нет необходимости быть очень чистым Легированный металл.
Поэтому, в комбинации с утилизацией тепла углерода Ферро-металл (Ферро-хром, Ферро-молибден、 Ферро вольфрам). Простая субстанция. Физико-химические свойства Property. In компактное состояние, Cr, Mo и W плотны Изотопом 15N. А. Юг»ЛЛЛ» Серебристо-белый металл. Все 3 металла имеют высокую температуру. Он растворяет и самый тугоплавкий в серии РФ. Вольфрам общий Это самый тугоплавкий из всех металлов.
Все 3 металла характеризуются отсутствием полиморфизма. До тех пор Они имеют решетки ОЦК. Химически, хромий, молибден и вольфрам очень inert. In В нормальных условиях он устойчив к воздействию воды и кислорода. Хром реагирует с разбавленными растворами HCl и H2SO4. Условия, поверхностная оксидная пассивированная пленка (состав аналогичен SG2O3) постепенно разрушается. Внутри стандартного потенциала электрода Хром находится между цинком и железом.
Молибден и вольфрам имеют коррозию. Стабильность кислой среды резко возрастает. Въедливая фильм близок к кислотообразующим оксида соответствующего кислоте Лот (Мооз и\?0z). Наиболее подходящим растворителем для Mo и W является расплав Щелочь в присутствии окислителя и высокотемпературной смеси HNO3 + HF: E + 3NaNO3 + 2NaOH = Na23O4 + 3NaNO2 + H20 E + 6HNO3 + 8HF = H2 [3F8] + 6NO2 + 6H2O Хром растворяет водород при высоких температурах, особенно с молибденом Вольфрам практически не поглощает водород.
При нагревании элементы подгруппы хрома вступают в реакцию с галогеном. Гены, пуниктоген (кроме висмута), неметаллический, Бор в группе IVA. Кроме Кроме того, они вступают в реакцию с большинством металлов с образованием твердого раствора. Или интерметаллические соединения. Характерные соединения. Соединения, содержащие кислоты По Chrome、+ 2、+ 3、+ 4、+ 6 указывает состояние окисления соответствующего Оксиды CrO, Cr2O3, CrO2, CrO3-MoO2 известны для молибдена. Mo2C> 5 и MoO3-для вольфрама известны только 2 окиси: W02 и\ UOz-
Итак, как и в предыдущем Б -, в серии Cr-Mo-W наблюдается. Увеличьте и уменьшите стабильность группы, более высокое государство оксидации Различные соединения, в том числе кислород. Оксид хрома (+3) представляет собой темно-зеленый порошок и не ржавеет. Воруют в воде, кислоте и щелочи.
Удобный способ приобретения лаборатории Cr2O3 представляет собой пиролиз дихромата аммония. = Cr2O3 + N2 + 4H2O Cr2O3 нерастворим, поэтому его гидроксид Cr (OH) 3, например Действие раствора аммиака на раствор соли Cr ( — ) — H): Cr2 (SO4K + 6NH4OH = 2Cg (OHK + 3 (NH4JSO4 Гидроксид хрома обладает свойством обоих полов. Со структурной точки зрения С видением, гидроксид хрома (+3), переменный состав Cr2O3 ′ ^ HgO、 Пространственная структура многоядерного комплекса.
Строительные конструкции Его октаэдр состоит из соединенных между собой [Cr (OH) b] 3 «и[Cr (H2O) b] 3+ О, на мосту. Относительное количество лиганда OH и количество H2O Это зависит от условий производства гидроксида хрома. Равновесие Различные формы Cr (+3) гидрокси и аква комплекса Наша схема СГ(ОК-xh2o было затрачено n [Cr(H2ONp * ^ = * [Cr (OH) s(H2OK])^ p = ^ и [Cr (OHNp- Кислотная среда нейтральная среда щелочная среда Как видно из этой схемы, регулировка Cr (+3) Номер 6.
Гидроксид, соответствующий оксиду хрома (+3) Однако он аналогичен алюминиевым соединениям AI2O3 и A1 (OH). в частности, сплавам Когда Cr2O3 образуется из оксидов щелочных металлов или карбонатов、 Me CrO2-производные аналогичного взаимодействия со щелочными производными Земные металлы, магний и железо (+2) приводят к образованию хрома Шпинели mecr 2о 4, и принадлежат к тому же классу соединения Шпинель MgAl ^ O ^free NSgO2 представляет собой синевато-серый Кристалл Aggregate.
It теряет влагу при 430°C из-за сильного самонагревания. Аквариумное растение Щелочь — производные метамфетамина (хромовая железная руда)、 Гидроксильные комплексы, например Cr (OHK + 3NaOH = Na3 [Cr (OH) b] Среди характерных соединений хрома наименьшая степень положительности Окисление 4-2 известного черного оксида CrO и соответствующего гидроксида Cr (OHJ is yellow. Cr (OHJ имеет только основные характеристики.
Cr (дегидратация в восстановительной атмосфере OHJ получается Оксид CGO становится непропорциональным при малейшем нагревании. В состоянии окисления+4 имеются соединения, характерные для всех 3 элемента группы VlB. Известен черновато-фиолетовый оксид хрома CrO2.
Высокий Mo02 и коричневый оксид WO2 CrO2 являются переменной фазой Композиция c дефектами в кислородной подрешетке (вычитание твердого раствора CxOh x). он кристаллизуется в решетке рутила Ti2.Диоксид хрома и его аналоги Нерастворим в воде, слабо растворим в кислотах и щелочах. Переписка с ними Гидроксиды неизвестны.
Наиболее типичная степень окисления молибдена и вольфрама Наиболее важным для Chrome является 4-6. MoO3 и WO3 принимаются непосредственно Термическое окисление металлов газообразным кислородом. Кристалл CgO3 При воздействии раствора дихромата калия он растворяется в ярко-красных иглах K2sg207 концентрированная серная кислота: K2Sg207 + H2SO4 = 2SO4 + 2CrO3 +Н2О CrO3 [CrO4]имеет тетраэдрическую цепную структуру. Прекрасный.
Систем moo3 и WO3、 8-я грань [EOb], соединенная вершиной. Низкая температура плавления CgO3 (A87°C), показывает выдающийся вклад Ван-дер-Ваальса Высокая температура плавления цепи, а также MoO3 и WO3 G95 и 1473°C Проверьте структуру регулировки. С химической точки зрения, Cr3O3, MoO3 и WO3 являются типичными Другими кислотообразующими оксидами соответствующих кислот: хромовой кислоты Н2СЮ4、 Молибден H2M0O4 и вольфрам H2WC> 4
- Этим кислотам соответствует большое количество солей: хромата, молибдата、 Фразы. Обычно хроматы окрашены в желтый цвет、 Кроф-ионные, молибденовые и вольфрамовые соли бесцветны. 1 из отличительных особенностей элементов группы виб 、 Окисление-это способность образовывать Поли соединения. Случай КР Возможно только образование производных изополикислоты; в Mo и W、 И производные heteropoly кислот.
В случае водных растворах Хром характеризуется образованием ионов CrOij, после чего концентрация увеличивается. Образование полихроматического аниона Cr2O3 + S +изополии Хромовая кислота известна только в растворе. Но этой соли очень много- Число. Наиболее важным является дихроизм. Они отличаются от желтых.
Хромат-красно-оранжевый и хорошо растворим в воде. Людмила Фирмаль
Решение Дихромат Рыбы имеют кислую реакцию, что объясняется взаимодействием двуцветные Мэтт Иона в воде в соответствии со схемой H2O + Cr2O? ^±2Н 2CrOf В результате в кислой среде равновесие смещается влево и разбавляется Вода или щелочная среда-правильно. Все хроматы являются сильными окислителями. Так, в холодное время они окисляются Привет, H2SO3 и их соли, а при нагревании-HBg и HC1: K2Sg207 + 14NS1 = 2KS1 + 2SgS13 + ZS12 + 7N2O
Соединение хрома (+6) характеризуется взаимодействием с перекисью водорода. При этом образуется перекись синего Кро. Н2Сг04+2Н2О2=ЗН2О+СгО5 Образуются также пероксиды хрома H2Cr20i2 и ЩСтОв. Все пероксок-хроматы Неустойчив, является самым сильным окислителем. МО(+6)и W(+6), ISO-и heteropoly- Соединение.
Структурные единицы комплексных анионов изополикислоты и гетерополикислоты Молибден и вольфрам являются восьмигранными[EOB].Эти октаэдры могут соединяться Между вершинными или реберными костями образуется комплекс frame. So сложно Состав аниона, связь с атомом водорода внешней сферы комплекса Перераспределение электронной плотности делает ее более полярной Прочность поликислоты увеличивается.
Однако в целом, как упоминалось выше, в серии Cr Кислотные свойства МО-в высоких оксидах и гидроксидах быстро ослабляются. В частности, h2m02mto4 и H2WO4 показывают значительные признаки обоих полов. Он выражается во взаимодействии с сильными кислотами: EO2(OHJ + 2HC1 = EO2C12 + 2H2O 452. Эта реакция также может быть выполнена в Н2Сг04, но в этом случае она сбалансирована Сильно сместился влево.
Соединения EO2C12 в водных растворах、 Шаблон EO2C12 ″ = * ЭОГ + 2С1- Оксокатион EO2 +называется хромил, молибден-Денил или вольфрам. Действие перекиси водорода в щелочной среде на раствор солей молибдена Вольфрамовая соль имеет общую формулу Me2EOp(где、 я = 5-8).С структурной точки зрения они похожи на соответствующие Это производное хрома и содержит от 1 до 4 пероксидов-O-O -、
Замещение анионов атомов кислорода EO|.Они окрашены в твердый цвет Ноны светлых тонов от красного до желтого. При нагревании он разлагается в результате взрыва И при комнатной температуре кислород медленно отделяется Он обладает сильными окислительными свойствами. Серия Cr-Mo-W Стабильность пероксидов при самой высокой степени окисления значительно улучшается.
Соединения с другими неметаллами. Большинство фторидов Из которых выделяются энергетические окислители, способные образовывать высшие ГАЛОГЕНИДЫ EHB rykh CrFg-твердое вещество, MoFe-низкокипящая жидкость, а WFg-газ. Указывает на усиление тенденции к образованию молекулярных структур Тур. Большинство фторидов образуется хромом. От +2 до + 6 состояний окисления (включая нехарактерные+5, не наблюдается)
5. в ряду оксидов).Низкосортные фториды CrF2 и CrF3 похожи на соль и являются refractory. In В молибдене, особенно вольфраме, количество известных фторидов значительно меньше Шея. Фторид в Mo и W не похож на соль. Среди хлорида хрома и его аналогов наиболее отчетливо видна стабилизация Высокая степень окисления от хрома до вольфрама.
Хлор может окислять хром Только вольфрам до CrCl4, молибден до M0CI5 и высокий хлорид WC16. Низшие хлориды хрома CrCl2 и CrCl3 являются типичными солеподобными соединениями Ния. CgC12 представляет собой бесцветное кристаллическое вещество, гигроскопичное и голографическое- Он растворяется в water. It отделяется от раствора в виде кристаллогидрата CrC12-4H2O, который следует рассматривать как водный комплекс[Cr (H2OL) C12.
Хлорид хрома (+3) также образует кристаллогидрат CrCl3 * 6H2O. Аква комплекс[Cr (H2O)b] Cl3 синий фиолетовый. Не похож на низкий хлорид Хромия, MoC12 и WC12 Это не такое соединение как соль、 Другими словами, так называемые кластеры Многоядерный комплекс c прямым подключением Между атомами комплексообразователей. Молекулы Кроме того, MoC12 является агрегатом mo6cli2.
Во Внутренней Сфере 8 атомов хлора Сложный многоядерный кластер[MobC18] 4+(рисунок 153), а 4 атома С1-экзосфера. Непо. Атомы МО связаны непосредственно друг с другом; Они называют правильный октаэдр. Все ребра, которые расположены ЯСТИКА Мостиковых атомов хлора соответственно 153.Структура октаэдра 3 атома МО одновременно、 Образуется тетраэдр с атомом С1 вверху и атомом металла внизу.
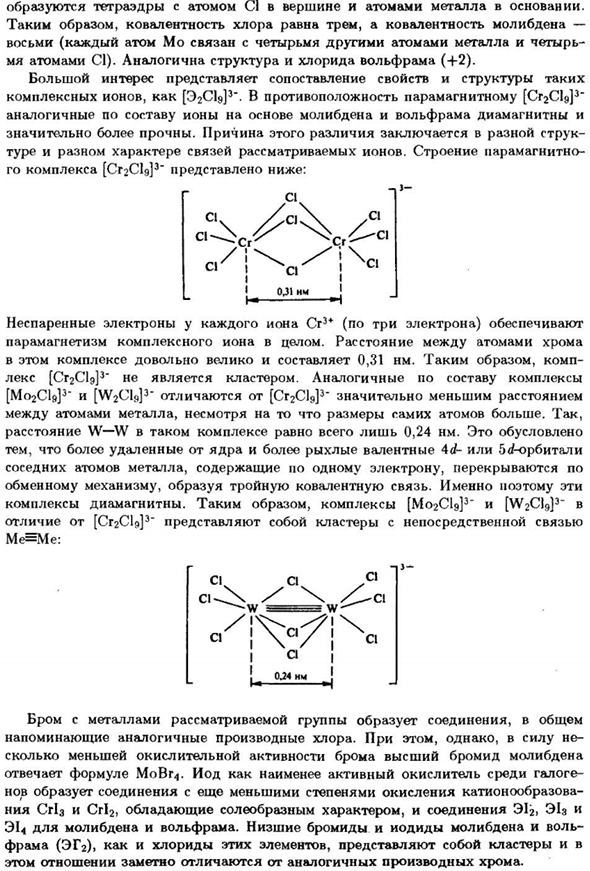
Таким образом, ковалентная связь хлора равна 3,а ковалентная связь молибдена равна 8 (каждый атом МО состоит из 4 других атомов металла и 4 Атома С1).Структура хлорида вольфрама (+2) аналогична. Очень интересным является сравнение таких свойств и структур [EGSS3]в отличие от сложных ионов, парамагнитных [EGSS3] Ионы молибдена и вольфрама аналогичного состава являются диамагнитными、 Он гораздо прочнее.
Причина этого различия заключается в другой структуре. О разном характере тура и связи ионов идет речь. Парамагнитная структура Пример комплекса [СггСЩ3 ″ показан ниже. — .Три- CL C1 C1 / Центр тяжести’ * УП 0,31 Нм С1. ChS1 Каждый неспаренный электрон Cr3 +Иона (3 электрона)、 Парамагнетизм всего сложного Иона. Расстояние между атомами хрома Он очень велик в этом комплексе и достигает 0,31 Нм.
Таким образом, комп Lex [O2CI9] 3 «не является кластером. Композиционно подобные комплексы [M02CI9] 3″и[W2C19] 3″ отличаются от [Cr2C19] 3 довольно коротким расстоянием Несмотря на то, что сам атом имеет большие размеры, intermetallic. So … W-W расстояние такого комплекса составляет всего 0,24 Нм. Это Более удаленная от ядра, более хрупкая валентность Ad или ba’or 1. соседние атомы металла, содержащие один электрон, перекрываются друг с другом Механизм обмена, который образует тройной ковалент bond. So это такие Комплекс диамагнитный.
Таким образом, комплекс[M02CI9] 3 «и[W ^ Clg] 3» В отличие от [Cr2C1d] 3, » кластер с прямым подключением Я=я: Бром с металлами рассматриваемой группы обычно образуют соединения Подобно производным хлора. Однако、 Насколько низка окислительная активность брома, насколько высок бромид молибдена Это соответствует формуле MoBr^.
Йод, как наименее активный окислитель среди галогенов Степень окисления катиона образует соединения, которые еще ниже Соединения Cr1z и Cr1g с солеподобными свойствами, а также соединения E1r, E1z и E14 для молибдена и вольфрама. Молибден и низкий объем бромида и йодида Флама (яйцо), а также хлориды этих элементов、 В этом отношении он существенно отличается от аналогичных производных хрома.
Все сульфиды металлов подгруппы хрома (Mo и W CrS, Cr2S3, 9S2 и EB) Он достаточно термически стабилен и обладает полупроводниковыми свойствами Он подчеркивает неметаллические свойства. Они все представляют. Имеет переменный состав с координационными кристаллами, особенно Особенности низкого уровня sulfides.
In в этом отношении они заметно отличаются друг от друга. Часто из галогенидов, которые образуют молекулярные структуры, или Группа. Взаимодействие с хромом, молибденом, вольфрамом, селеном и теллуром Вольфрам с меньшей энергией и теллуром не образует соединений. Известны также случаи, когда в системе образуется небольшое количество соединений.
Наиболее стабильное состояние окисления (СГХ, СГ2Х3, WSe2、 WSe8, MoTe2, MoTe3). К классу относятся фосфиды, Арсениды и нитриды хрома и его аналогов Аномально сконструированный дальтоник, включающий «анион-анионный» и » катионный» Катионное » связывание. Наиболее характерными для фосфидов являются соединения состава Е3Р、 ER и ERg-моно и дифосфотидные образования, как правило, являются、 Свинцовый металл.
Все 3 элемента имеют дисилицид 9Si2. Тугоплавкое соединение с полупроводниковыми свойствами. Нежно. Стороны устойчивы к агрессивным средам на высоком уровне temperatures. In система СГ-Си, в присутствии соединения a; обработка стержня, с ^ Си, Си ^ Си, первая из которых рых является полупроводником, остальные 2 являются metallized.
So … Наблюдается та же картина, которая была отмечена для некоторых силицидов хрома Для фосфидов. Соли кислородсодержащих кислот и комплексов нью-йоркское соединение. CrSO4 является относительно стабильным Серную кислоту добавляли в отсутствие кислорода. Твердые сульфаты Хром (+2) изоморфен сульфату железа (+2), и оба образуют кристаллы 9SO4 * 7H2O. Химия хрома (+2) в некотором смысле аналогична химии Железо (+2).
Таким образом, в случае Cr (+2) известно соединение K4 [Cr (C1H) b]、 Существует также состав желтой кровяной соли K4 [Fe (CNN]) и тиоцианата Комплекс K4 [Crsn]. При легировании пиросульфатом калия оксид Cr2O3 заменяется на Cr2 (SO4K、 Образует двойные соли типа сульфатов щелочных металлов и квасцов. Тенденция к образованию квасцов в Хроме даже ярче, чем в алюминии、 И эти двойные галогениды более стабильны.
Хром-это лучшая сложность Алюминий больше body. In хром, в отличие от алюминия, в интерьере 3d- Оболочка с частично свободной орбитой доступна для участия Взаимодействие между лигандом донора и acceptor. In алюминий, 3 ^оболочка Он существует, но является внешним и полностью empty. It-это не так.
Итак, в координации № 6 хром является внутренним<Рвр3-гибким ридизация, а алюминий-внешняя sp3 (^- гибридизация с низкой прочностью Связей стало меньше. Все 3 металла подгруппы хрома образуют один и тот же тип гексакарбонила. Me (CO) b, степень окисления металла формально равна нулю.
Все это Карбонил представляет собой бесцветный ромбический кристалл, он стабилен 180 ° С в воздухе до 200°. в карбонильном комплексе атом металла В состоянии аномально низкого окисления Стабилизация этого state. In добавление к изолированным электронам таких лигандов Четыреста пятьдесят пять Металл подгруппы марганца содержит всего 2 НС электронов、
Электронная оболочка-стабильная наполовину заполненная (n-l) д. С этим Причина в том, что элементы подгруппы марганца играют в основном типичную роль Переход metal. At в то же время, химия элементов подгруппы марганца Высшая степень окисления приобретает логическое сходство со 2-й химии. Типичный элемент хлора.
Смотрите также:
| Сера | Фтор |
| Подгруппа селена | Хлор |
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
