Оглавление:








Сера
- Серный. Химические характеристики серы. 2-я типичная химия Элементы VI группы-сера-по меньшей мере отличаются от оксигенации 2 стороны. Во-первых, увеличивается присутствие в небе 3 радиочастотных орбит. Возможность серы, учитывая ускорение электронов на этих орбиталях.
- В то же время повышается и положительная степень окисления серы. Также Создаются условия для дополнительного взаимодействия тг. Наконец-то втянулся 3rf орбита резко увеличивает количество возможных типов гибридизации、 Во-вторых, о химии серы, о прочности химических связей Его атом является 2-м, уступая только C — C и Si — O-Si межатомным bonds. So … Например, гомоканальные производные играют специфическую роль в химии серы.
Увеличение координационного числа серы в производном. Людмила Фирмаль
При этом образуется сера, такая как полисульфиды и политионовые кислоты Гетерохронная структура, содержащая атом кислорода. Это манифест. Горизонтальная аналогия ряда силиконы-фосфор-сера. Производство природных соединений и серы. Серный. 1. один из общих элементов. Открытие формы серы Многолюбраз- Реакция с ртутью протекает даже при температуре жидкости air. In его очередь、 Радий, сера, а также кислоты полностью окисляются кислородом и галогенами Oxidant.
In щелочные растворы при высоких температурах становятся несбалансированными. 3S + 6NaOH = 2Na2S + Na2SO3 +ЗН2О В большинстве случаев сера является-2、0、+ 2、+ 4、и даже состояние окисления+6. Характерные соединения. Кислота Он содержит серу и ее соли. Горящая сера в воздухе、 Он производит диоксид серы (сернистый ангидрид) с резким запахом. Токсичный. Он легко сгущается в непроводящий liquid.
In технология получения диоксида серы При окислительном обжиге сульфидов металлов и в лабораторных условиях- Вий концентрированной серной кислотой медь: Cu + 2H2SO4 = CuSO4 + SO2 +2Н2О Химическая структура молекул диоксида серы аналогична структуре молекул озона. Атом серы находится в состоянии» гибридизации p2″.
Из-за большого размера Атом серы, длина s-O @связи, 143 Нм) больше, чем O-O @в молекуле, 128 Нм Озон. Но с точки зрения энергии, S-O связь молекулы SO2 D89 кДж / моль) в несколько раз больше Озон в O — O связи A14.2 кДж / моль) превышает. Это связано с дополнениями ^ Свободные d-орбитали атома серы и замечательные Вклад ионной части связи в случае молекул SO2. Полярная молекула SO2 очень растворима в воде. Только небольшая часть.
Растворенные молекулы взаимодействуют с водой, и устанавливается равновесие. ЅО2 + Н2О * = * H2SO3 ^ НЧ ГПО ^ 2Н + + + так! ’ Равновесие сильно смещается влево. Серная кислота H2SO3 не выделена Это кислота средней прочности (pa’I 1.7 и pA’2 7.3).Серная соль Его получают взаимодействием кислоты-сульфита и гидросульфита-SO2 со щелочью Сами или растворимые карбонаты металлов.
Из-за нестабильного состояния окисления работают+ 4 SO2, H2SO3 и сульфиты Они рассматриваются как восстановители. Медленно, даже с твердыми сульфитами в хранении Окисление до сульфатов: 2Na2SO3 +О2= 2Na2SO4 Однако в сильном восстановителе производное серы (+4) указывает на окисление Некоторые свойства, например, SO2 + 2H2S = 3S +2Н2О (дисбаланс).
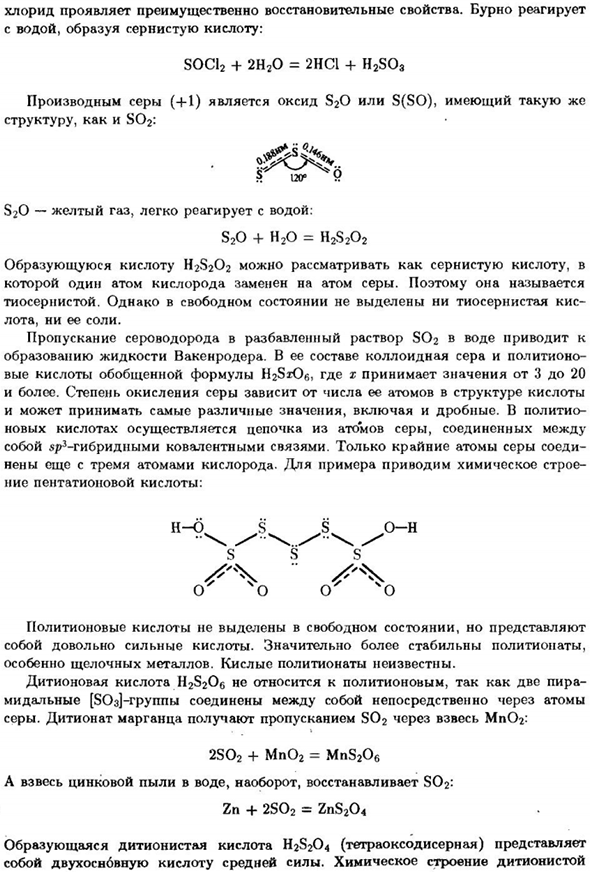
При нагревании гидросульфит превращается в пиросульфит-соль неизвестна Свободное состояние пиросульфатной (дисперсионной) кислоты H2S2O5: 2KHSO3 = K2S2OS + H2O Производное серы (+4)-тионилхлорид SOC12-получали реакцией SO2 + PCls = POC13 + SOC12 Тионилхлорид-бесцветная жидкость с резким запахом. Химическая структура Его молекула пирамидальна, а атом серы является»Pz-гибридом».
Тионил Хлорид в основном восстанавливается. Они реагируют бурно. С водой образуется серная кислота: SOC12 + 2H2O = 2CH1 + H2SO3 Производное серы (+1) представляет собой SiO2 или s (SO) оксид, то же самое Структуры, таких, как SO2: Что это? 120. » S2O-желтый газ, легко реагирует с водой: S2O + H2O = H2S2O2 Полученную кислоту H2S2O2 можно считать серной кислотой.
Какие атомы кислорода заменяются атомами серы? Поэтому он и называется Тио сера. Однако в свободном состоянии ни одна тиосульфуроновая кислота не была отделена. Много-много соли. При введении сероводорода в разбавленный раствор SO2 растворяют в воде、 Образование жидкости Вакенродера. Содержит коллоидную серу и политионовую кислоту Кислота с обобщенной формулой H2Si06.Где x принимает значение 3-20.
И так далее. Степень окисления серы зависит от количества атомов в структуре кислоты Вы также можете принимать различные значения, в том числе десятичные значения. PolitiFact. Новая кислота、 yar3 гибридные ковалентные связи. Только экстремальные атомы серы Несс с еще 3 атомами кислорода.
Например, дайте ему химическую структуру Пентатионовая кислота: Да. О ’о’ О К Эй. Политионовая кислота не отделяется в свободном состоянии、 Довольно сильная кислота. Чрезвычайно стабильная политика、 Особенно щелочной металл. Кислые размышления не известны. ДИТИОНОВАЯ кислота H2S2O6 не является политионовой кислотой.
Центральная группа [8Оз]связана непосредственно через атомы Серный. Дитионат марганца получают пропусканием SO2 через суспензию MnO2. 2SO2 + MnO2 = MnS2O6 Напротив, если цинковая пыль суспендирована в воде, SO2 восстановится. Zn + 2SO2 = ZnS2O4 Полученный ДИТИОНАТ H2S2O4 (тетраоксо бисульфат) Бикарбонатная кислота средней прочности.
- Химическая структура дитионистов ЛЫ Симметричная кислота, содержащая 2 четырехвалентных атома серы. Дижонист. Кислота и ее соли-дитионит-легко окисляются кислородом до сульфатов. Как и дитионовая кислота, состояние окисления составляет+3, сера имеет 1,5 Оксид BzOz-получен тонким взаимодействием с высушенным триоксидом SO3. Сера на земле. 1.5 оксиды не являются стабильными и несбалансированными. Позиция: 2S2O3 = 3SO2 + S Степень окисления серы сульфоксильными (диоксо-серными) кислотами еще ниже.
То, что возникает из-за гидролиза дихлор-серы SC12: SC12 + 2H2O = 2CH1 + H2SO2 Достоверно установлено, что существует только 1 из его солей, CoSO2-сульфоксиды. Кобальтовая броня. Официально такая же степень окисления серы+2、 Последний. Он образуется при кипячении крепкого раствора мелкоизмельченных сульфитов Серый: Na2SO3 + S = Na2S2O3 Это тиосульфуроновая кислота, но близко к серной кислоте.
Атом серы Тио-серной кислоты H2S2O3 и ее соли-тиосульфат. Людмила Фирмаль
Тиосульфат-Ион Связь S — S является слегка искаженным тетраэдром, потому что она длиннее, чем связь S-O. ; Тиосульфат также окисляется, например, мягким окислителем. 2Na2S2O3 + H = Na2S4O6 + 2NaI Диоксид серы на свету легко окисляется хлором: ЅО2 + С12 = SO2C12 Сульфурилхлорид SO2C12-это бесцветная жидкость, которая делает smell. It-жарко.
Разложите в образовании серной кислоты: SO2C12 + 2H2O = H2SO4 + 2HC1 Структурно он может быть представлен как продукт замещения обоих гидроксидов От сульфата до атома хлора. А потом берем 1 гидроксил Хлор получают с помощью хлорсульфоната HSO3Cl. Хлорсульфоновая вода Кислота разлагается, а также сульфурилхлорид разлагается. Согласно химической структуре сульфо Хлорид Рилла представляет собой искаженный тетраэдр.
Четыреста тридцать девять При высоких температурах, в присутствии катализаторов, оксидов серы (+4) Окисляется кислородом с образованием оксида серы (+6): 2SO2 + O2 = 2SO3 / В парообразном состоянии триоксид SO3 существует в виде молекулы с атомами Сера в центре равностороннего треугольника (гибридизация j2).Жидкое состояние Лаборатория триоксида серы представлена trimer.
In их, атом серы является расплавление гибридизации jar3 образует тетраэдр. Тетраэдры связаны между собой Сшитые атомов кислорода. В твердом состоянии, в so3 имеет сеть гетеро Полимерная структура. Растворение SO3 в воде сопровождается выделением тепла(D#°98 = −62,7 кДж / моль) и образование серной кислоты : SO3 + H2O = H2SO4 Серный ангидрид, также называемый моногидратом Без запаха, бесцветная маслянистая жидкость.
Ведут себя в водном растворе Как самая сильная двухфазная кислота (pK \ 3 и pA’2 2).Химическая структура В молекуле серной кислоты H2SO4 соответствует искаженный тетраэдр. В широком диапазоне、 Сгорание Иона сульфата водорода HSO^ — SO4、 Тетраэдр, все расстояния и углы между связями в нем эквивалентны: О Я Хо -» — / с = ^ о Но… Но… О О Концентрированная серная кислота является сильным окислителем. В зависимости от При снижении мощности, диоксид серы, сера、 Сероводород.
Большинство сульфатов бесцветны и хорошо кристаллизуются из водного растения. Вор выделяется как гидрат кристаллов. Термостойкие сульфаты Листовые и щелочноземельные металлы. Сульфаты менее активных металлов Он разлагается при нагревании, например: ZnSO4 = ZnO + S03; Ag2SO4 = 2Ag + S02 + 02 Соль водорода серной кислоты легко растворима, и после плавления она поступает в пиросульфат (Дисульфат I: 2NaHSO4 = Na2S2O7 + H20 Пиросульфатная (дизелиновая) кислота H2S2O7、
Содержание so3 в моногидрат. В целом, серная кислота может присоединить боли Большое количество SO3.Такой раствор очень вязкий、 Олеум (как масло).Состав дымящей серной кислоты определяется по формуле Н2ЅО4-zSO3. при Х = 1 получается Ди-молочная кислота. Ока-это Бесцветные кристаллы эквимолярном при охлаждении до комнатной температуры Смесь H2SO4 и SO3.
Особенности химического строения дисперсной кислоты Дело в том, что атомы серы связаны через кислородный мостик Думайте об этом как об изополиновой кислоте. Дымящая серная кислота также содержит трисульфокислоты и тетралсульфокислоты Кислота. Олеум по сравнению с концентрированной серной кислотой Еще больший эффект поглощения и окисления воды.
Взаимодействие хлорсульфоновой кислоты и перекиси водорода Пероксо-серная кислота. Моносульфат пероксодона (Монодон) H2SO5 (или кислота (Каротиноиды) и пероксиды (бисульфуровая кислота) H2S2O8 бесцветны Гигроскопичные кристаллы. Обе кислоты бурно реагируют с водой: H2S2O8 + H2O = H2SO5 + H2SO4 H2SO5 + H2O = H2SO4 + H2O2 Пероксодисульфокислоту в этом способе получают анодным окислением сульфата водорода. Жирный анион.
Во-первых, на аноде, анион сульфата водопода Радикал водорода серной кислоты для димеризации: 2HSOi-2e » = 2HSO4; 2HSO4 = H2S2O8 Пероксо-серная кислота и ее соли-пероксо-серная кислота-самые сильные Окислитель. Таким образом, если процесс S2OJ3 + 2e — = 2SO4, то окислительно-восстановительный потенциал равен + 2.01 в Соединения серы и других неметаллов.
Более важный Наиболее характерным летучим водородным соединением серы является сера Водорода. Чтобы получить его, Н2Ѕ Сульфид железа, соляная кислота: FeS + 2HC1 = FeCl2 + H2S Сероводород является бесцветным газом тяжелее воздуха и имеет неприятные запасы Дома. Он очень токсичен. Отравляющее действие сероводорода объясняет это Взаимодействие с гемоглобином iron. In добавление, как функция гемоглобина Тело, несущее кислород, нарушено или полностью парализовано.
Химическая структура Если не принимать во внимание низкую степень гибридизации, то H2S имеет сходную структуру с водой Орбита атома серы. Молекулы H2S гораздо менее полярны, чем молекулы воды、 Потому что серы меньше, чем кислорода. Таким образом, в сероводород Водородные связи практически отсутствуют в любом агрегатном состоянии. Рыдать Фактическая ионизация сероводорода незначительна, а его ионные продукты [ХГС+] [УГ «] = 10-33.
Ионизация сероводорода в воде H2S + H2O ^ H3O + + HS » Слабый сероводород H2S (pifj 7.3 и ПК2 13.8).Сероводород (сульфид) тяжелых металлов в воде) Нерастворимый. Четыреста сорок один Водный раствор сульфида щелочного металла растворяет и образует серу- Низкий полисульфид: Na2S + S = Na2S2; Na2S + 2S = Na2Ss и др. «Когда содержание серы в полисульфидах увеличивается、 Ров меняется с желто-оранжевого на красный (Na2Sg).Из полисурфида.
Получают водород серы-полисульфан. Из-за этого концентрация Медленно влейте раствор полисульфида в соляную кислоту: 2CH1 + Na2Sx = 2NaCl + H2SX Тяжелая маслянистая жидкость, состоящая из смеси, собирается на дне контейнера Полисульфан H2SX. Все члены серии до H2Sg были идентифицированы. Моль. Полислуксур и полислфид зигзагообразны. различные цепи атомов серы в bp3-гигридном состоянии: А. А. / С. з, ы, ы.
Цепь замкнута атомом водорода (полисульфаном) или атомом щелочи. Металл (полисульфид). в воде полисульфан является кислотой、 По мере увеличения количества атомов серы в полисульфид-ионах увеличивается прочность кислоты. Именно поэтому тетрасульфан H2S4 является более сильной кислотой, чем уксусная кислота, особенно сера Водород.
Полисульфиды более стабильны, чем полисульфан, и проявляют окисление Строительные и ремонтные свойства. Соотношение серы и галогенов регулируется в основном факторами ОЭЭО. Однако фактор размерности также играет определенную роль. Йод, что мы видим 6) то же, что и в случае серы б, не образует соединений с серой. Максимальный Соединения с серой образуют фтор. Крошечные различия между этими элементами Тавриетта 1.3.Известны хлориды серы SC12 и S2C12.
Насчет бромида серы. Только S2Br2. При прямом фторировании серы образуются примеси S2Fio и SF6. СФ4. Гексафторид SF6-это газ, который очень устойчив к химическому воздействию. Он был Не вступает в реакцию с водой, щелочами, кислотами, водородом, металлами. Его молекула Неполярная октаэдрическая структура (sp * (^- гибридизация атомов серы).
Так, в молекулах SF6 атом серы просто насыщен валентностью и координацией. Это рана защищенная 6 фтором atoms. In кроме того, особенности связи S-F являются: С21. 3 кДж / моль для высокопрочного). в то же время, показывающ вычисление Реакция гидролиза между SF6 и образованием SO2 и HF、 DS°d8 = −460 кДж.
Таким образом, в целом низкая химическая активность SF6 Не термодинамической стабильностью, а кинетическими факторами Из этого вещества. SC14 четыре-хлористой серы неустойчива. Они диссоциируют при комнатной температуре. Уменьшить хлор с хлоридом серы.
Хлорирование расплавленной серы、 Образование смеси дихлорида серы и монохлорирования. Дихлорид нестабилен и медленно разлагается. Задержка: 2SC22 = S2C22 + С22 Четыреста сорок два SCI2 молекулы углами с атомами серы в состоянии вр2-гибридизации. Стабильный. Кости моногарида S2r2 восстанавливаются от фтора до брома. Все они легко гидро- Лизни воду.
Сульфид металла. Потому что значение OEO значительно меньше Сера по сравнению с кислородом B, 6 и 3,5) сульфиды металлов более ковалентны Чем оксиды. Низкая ионная природа межатомной связи、 Сульфиды металлов、 В отличие от оксидов, большинство из них являются изоляторами.
Если оксид бесцветный Или слабо окрашенные сульфиды часто отличаются темным цветом. Это связано с тем, что при переходе от кислорода к сере、 Оболочка, и тем самым возможность deform. In другие слова Атом серы в сульфиде более склонен к поляризации, чем атом кислорода в оксиде. В этом случае, вследствие увеличения поляризационного действия катионного агента, прочность Окраска будет увеличиваться.
Таким образом, иго-красный, компакт-диски-оранжевый, ЗНС-желтый Цвет. Химические вещества для нормальной Стехиометрии щелочных сульфидов Какая природа является основной? Поэтому во время их гидролиза щелочь Окружающая среда, например Na2S + H2O ^ NaHS + NaOH, RL™dr −1 NaHS + H2O ^ H2S + NaOH, pa’hyr 7. Сульфиды щелочных и щелочноземельных металлов окисляются кислородом Подвергается воздействию тепла углерода путем образования воздуха, хлора и карбидов Металл.
Общий сульфид формирует главным образом металл sp, специально Внешний электронный ns2npl (Al, Ga, In, T1).Большинство из них являются Диоды имеют сложную кристаллическую структуру, образуют слои и координаты. Structure. By химическая природа, эти сульфиды бисексуальны, слегка Устойчив к воздействию химических реагентов и активно взаимодействует Кислород, галоген.
Наиболее разнообразны сульфиды переходных металлов: Me2S, MeS, Me, -?S4、 Me2S3, MeS2, MeS3.Многие из этих сульфидов (особенно не зависимые Формальное правило связывания-валентности) — соединение переменного состава. Должный к низкому содержанию серы смешивая блока, скрепление главным образом Металлы, то есть эти сульфиды похожи на металлы. По мере увеличения Появление связей между атомами серы и содержанием серы Полупроводник. Лантаноиды имеют самое высокое сродство к сере.
Например Энтальпия Mer, LaS (ДА} 298 = −751.3) и ce2s3 (да} 298 = −1257.2 кДж / моль) на 1 число больше, чем для многих общих сульфидов. Среди сульфидов лантаноидов наиболее изученными являются MeS и Me2Ss. Первый металл Аналогично, последний является полупроводником. Химическая устойчивость к действию Различные реагенты несравнимы с другими видами сульфидов металлов. Особенно ценными качествами являются、 Сплав солей, металлов и сплавов.
Смотрите также:
| Подгруппа ванадия | Подгруппа селена |
| Кислород | Подгруппа хрома |
Если вам потребуется заказать решение по химии вы всегда можете написать мне в whatsapp.
