Оглавление:



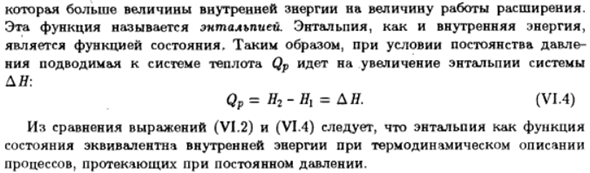

Понятие о химической термодинамике
- Понятие химического вещества thermodynamics. To изучение химических процессов К нему следует подходить серией последовательных approximations. At первый этап Рекомендуется рассматривать только начальные и конечные состояния взаимодействия Вещества, которые не учитывают пути протекания процесса и развития Процесс во времени.
- Это термодинамический подход. Химический Исследования термодинамики с использованием законов общей термодинамики Химические и физико-химические процессы. В том числе термохимия, образование Химические равновесия, жидкости и твердые растворы, фазовые переходы Возможность спонтанного процесса. Сто двадцать один Мне 1 год
Для удобства исследования, необходимо выделить объект исследования Окружающее пространство. Людмила Фирмаль
Совокупность таких тел, изолированных от космоса ва образует систему. Когда система способна к массе и передаче тепла между всеми Ее составляющие, такие системы называются термодинамикой. Химия Химическая система, в которой может происходить реакция Частный случай термодинамики. Между системой и окружающей средой Из-за отсутствия Массо-и теплопередачи такая система называется сепарацией. Если нет массопереноса, но возможен теплообмен, то система называется Закрытый.
И система, и окружающая среда Передача тепла, система открыта. Система, состоящая из нескольких фаз, называется Гетерогенные, однофазные системы-однородные. Постоянная реакция Однородная система развивается по всему объему и называется однородной. Реакции, протекающие на границе раздела фаз, называются неоднородными.
- Состояние системы определяется ее свойствами. Свойства делятся на Интенсивные(температура, давление, концентрация и др.)) Каждая точка системы и широкий диапазон, в зависимости от количества вещества Или масса. К последним относятся, например, объем, энергия, ее величина В какой-то момент система теряет смысл. Как для централизованного, так и для внешнего использования Что касается физических свойств, то измерения физических величин не включают в себя время.
Я все объясню. Это связано с тем, что термодинамика изучает равновесный процесс. Состояние системы Может быть представлен аналитически в виде так называемого уравнения состояния f (P, V, T)= 0、 Свяжите все параметры системы. Некоторые типы уравнений состояния Она известна только в ограниченном числе простейших объектов.
Например Уравнение Клапейрона Менделеева (II.1)идеальное уравнение состояния Газ. Людмила Фирмаль
В большинстве систем явная форма уравнения состояния является Хорошо известны, для термодинамического описания системы, так называемые Государственная функция. Последнее означает любую физическую величину、 Величина однозначно определяется термодинамическими свойствами Система. Особую роль играет государственная функция, с помощью которой Он явно выражает все термодинамические свойства системы.
Такие свойства Состояние называется характеристическим. 1 из основных функций ситуации является полная энергия Система E. Это в общей сложности 3 компонента. Энергетической системы ^в движущейся системы, потенциальной энергии е ^ м ^、 Воздействие внешнего силового поля на систему и внутренняя энергия системы U: Э-Э K1LN В термодинамическом описании система является Состояние относительного покоя (#kin = 0) и влияние внешних полей Слишком маленький.(Енот= 0) —
Полная энергия системы определяется ее резервной мощностью Внутренняя энергия(Е-Щ. Количественный учет всех внутренних компонентов Энергия невозможна, но в термодинамическом анализе системы ее нет Достаточно только знать изменение внутренней энергии Когда система переходит из одного состояния в другое, и В этих состояниях она не абсолютна. В соответствии с По законам сохранения энергии 、
Первый закон термодинамики, общий запас внутри Без тепла, энергия остается постоянной. Окружение и вой. В процессе Протекает через изолированную систему Перераспределение внутренней энергии Системные компоненты. Тепло, передаваемое в систему, потребляется pri или P. 69.To описание тела Повышенная внутренняя энергия и усиленная работа Против внешних сил: рений С \ р х Q = AU + A (Ви. Один) Уравнение (VI. 1)является математическим представлением начала начала Термодинамика• — закон сохранения энергии.
Для визуальных презентаций Физический смысл работы над внешними силами мы рассматриваем в системе, представляющей собой Газ окруженный баллонами отделен от окружающей среды Поршень движется без трения(рис. 69).Если поршень не закреплен должным образом При определенном (V = const) теплопередача в систему полностью исчезает Накопитель внутренней энергии Гв = П、 (Ви. Два) Потому что задача развертывания С V = const равна нулю.
Если вы дадите сейчас Благодаря способности поршня свободно перемещаться, газ расширяется и выполняет свою работу А = FН = пш、 Где F-сила, действующая на поршень. h-высота перемещения поршня. п- Давление S-это площадь поршня. Потому что Sh = V-это изменение объема、 А = РСР = Р (В2-ЧХ). Это условие постоянного давления или изобарическое условие (p = — константа.)И затем… Qп = АС + П(П2-ЧХ). Ui и G2 указывают на подачу внутренней энергии на начальном и конечном этапе Состояние, то {{ / .= С2-У .И затем… — К.、)
Или Представляем новые возможности U + pV = H、 (Ви. Три) Сто двадцать три Это только больше размера работы расширения, чем размер внутренней энергии. Эта функция называется энтальпией. Энтальпия, как и внутренняя энергия、 Функция государства. Поэтому в условиях постоянного давления Теплота Qp, подаваемая в систему, увеличивает энтальпию системы JY: Qп = Н2-у = Ан. (ЧЕРЕЗ) Формулы (VI.2) и (VI. 4)из сравнения следует, что энтальпия является функцией Состояние, соответствующее внутренней энергии в термодинамическом описании Процесс, который происходит при постоянном давлении.
Смотрите также:
| Трансвлияние | Экзо- и эндотермические реакции. Основы термохимии |
| Природа химической связи в комплексных соединениях | Направление химических процессов. Энтропия. Свободная энергия |
