Оглавление:









Природа химической связи в комплексных соединениях
- Природа химических связей комплексных соединений. Электро Статический вид. Простое статическое электричество. Модель (Коссель и Магнус, 1916-1922), сложные-как взаимодействие По закону кулона атомами и ионами (или полярными) лигандами. Частицы, образующие комплекс Бесформенные шары с постоянным зарядом и радиусом. Стабильный.
- Сто тринадцать Я Комплекс получается, когда притяжение к ядру комплекса сбалансировано Отталкивание между лигандами. Согласно закону кулона, сила компа Лекса увеличивается с увеличением заряда и уменьшением радиуса комплексного числа Тейлор и лигандо. Поскольку стабильность уменьшается в направлении от комплекса фтор в Иодо комплекс、
Например, комплекс галогенидов алюминия[AIFJ » Людмила Фирмаль
Как и в этой серии, размер лиганда будет естественным образом увеличиваться. Устойчивость Комплексы с тем же лигандом в более высоком состоянии окисления Комплексообразователи всегда высоки. Например, K.+ / mc \ i + = 10 1 и ^ tho 9 + / xi m> + = 10 3 — сила отталкивания между ионами [КР ^(JNH3LJ ’ Между нейтральными лигандами, координационное число комплексов с ионами Лигандов меньше, чем комплексов С дипольными молекулами.
Есть Ион Co2 +Gundo создает комплекс с KB = 4, но в случае дипольных молекул [Co (CNSL) Два- Но… Количество регулировок увеличивается до 6:[Co ^ rO ^ r] 2 ′ [Co (H20N] 2+и [Co (NH3N] 2+). Электростатическая теория очень ясна, поэтому вы получаете заключение высокого качества В настоящее время он широко используется. Но она не может объяснить Много фактов: 1) почему существуют комплексы С неполярными лигандами Комплексообразователь в состоянии нулевого окисления, например, [Fe (CO) s]、 [Ca (NH3) e] и др.; 2)
Каковы причины магнитных и оптических свойств соединения Нина. Метод валентной связи.. Очень визуальный способ написания Комплексное соединение MVS было предложено и разработано Полиной. Главная в 30-х гг. Этот метод основан на следующих моментах: 1.Взаимосвязь между комплексообразующим агентом и донорно-акцепторным лигандом. Лиганд обеспечивает электронную пару, а ядро комплекса обеспечивает свободную орбиту. Подъем.
Мерой прочности связи является степень перекрытия орбит. 2.Орбитали центральных атомов участвуют в образовании связей Гибридизация. Тип гибридизации зависит от количества, природы и Электронная структура лиганда. Гибридизации электронных орбит комп модификатор определяет геометрию комплекса. 3.Дополнительное укрепление комплекса осуществляется за счет- Соединение также вызывает соединения tg.
Это происходит, когда он занят электронами Орбиты центральных атомов перекрываются с орбитами пустых лигандов. происходит перераспределение электронных плотностей в результате связей а и ТГ Перемещение в противоположном направлении: когда<T-связь происходит、 От носа к комплексообразователь, от носа до лиганд. 4.Магнитные свойства комплекса、 Орбита population. In наличие неспаренных электронов, то- Магнитный.
Спаривание электронов определяет диамагнетизм комплекса Соединение. Рассмотрим, как МВС описывает некоторые электронные структуры и свойства Комплекс Ry, образованный металлами первого переходного ряда: медь、 Цинк, никель и кобальт. При образовании комплекса распределение электронов по радиочастотной траектории комп Лексоген может оставаться таким же, как и лексоген изолированного Иона.
Чтобы испытать изменение{tab! 14). в приведенном выше примере медь, никель [NiClJ2 «и [CoFe] 3 кобальт», сохраняя при этом электронную структуру катиона、 С другой стороны, в остальных комплексах произошло электронное сопряжение. Иммунитет Данные электронные орбитали участвуют в образовании связи A<T с лигандом. Как вы можете видеть из таблицы. 14, при образовании октаэдрического гибридизационного комплекса Вы можете сделать это с помощью внутренних (n-1)<yerbitals. ([Co (CH3) b] 3+), или внешние орбиты nrf ([CoFg] 3″).Таблица 14 показывает、
Электронная пара комплексообразователя обозначена сплошной стрелкой、 Лигандные электронные пары, ответственные за связывание донора-акцептора<t、- Пунктирная стрелка. sp3 внешняя орбитальная гибридизация (P-связь Он образует более дальнюю, менее плотную орбиту 4L. Степень перекрытия В этом случае наблюдается меньшее электронное облако и меньшая связь между лигандом и комплексообразованием REM слабее, чем внутренняя гибридизация.
Следовательно, комплекс[CoFg] 3 ″ Замещение ионов фтора является простым и высокореактивным. [Co (CH3) b] 3+. в этом случае внутриорбитальный hybridization. It приводится в таблице. Электронная структура 14 комплексов правильно отражает их магнитные свойства Вау. Так, [КР(NH3J]+, Иона [ZN(NH3 л] 2+), [ни(ЗКГ] 2-,[со(NH3N]] 3+является диамагнетиком. Нет непарных electrons. In контраст, [NiClJ2 «и [CoF6] 3» para- Это так magnetic. In кроме того, парамагнетизм этих соединений пропорционален количеству Неспаренный электрон.
MVS позволяет интерпретировать комплекс с нейтральными лигандами、 Комплексообразователь нулевой степени окисления, например карбонил Металл. Недостатки MVs: 1) подходит для описания только ограниченных кругов Вещество. Отсутствуют комплексные соединения с многоцентровым соединением МВС 2) не описывает и не предсказывает оптические свойства комп Потому что он не учитывает возбужденное состояние, лексические соединения. Теория кристаллического поля. Теория кристаллов г ’¦ я Р * Я)1- P и c. 64.
Направление D-орбитали комплексообразователя в октаэдрическом поле Лиганды Поле (TCH) — это дальнейшее развитие, основанное на квантовой механике Электростатическая теория косселя и Магнуса. По данным ТЧ、 Ядро комплексов и ион * или ионный диполь ligands. In этот комплекс «Воспитатель» будет рассмотрен вместе с подробным описанием его электронной структуры. Лиганды-как электрически заряженные точки, без структуры, которая производит электростатический заряд.
Небесное поле. ТСН направлен на рассмотрение следующие изменения: Некоторые возникают в комплексообразователях под влиянием Лигандных полей. Вырождаться Орбиты, характерные для изолированных атомов или ионов металлов、 Сферическое поле лиганда частично удаляется. Причиной для разрыва вырождения разница в форме радиочастотной траектории и направлении в пространстве. Рисунок 64 by Размещение D-орбитали октаэдра комплексообразователя Сложный.
Орбитальная электронная плотность d»и d»»、 Ось, орбита d. d, d расположена вдоль биссектрисы ху х * УГ г Ху Между осями. Таким образом, электронный д«И Д ¦ — Траектория (обозначается Опыт со стороны отрицательно заряженного лиганда более отталкивающий- в результате энергии, чем электроны других 3 орбит называется de ^ 7 орбиталь увеличивает и уменьшает энергию rfe orbits. It это происходит. Разделение энергии (рис. 65). в этом случае<7 «〜°Rbitals втягиваются 2 раза ny, и rfe ORBIT-3 раза. dt-энергетическое расстояние между Энергия называется энергией расщепления и обозначается D-D.
Так как среда Орбитальная энергия должна оставаться неизменной, поэтому энергия 3 уменьшается Множественные вырожденные траектории rfe должны быть компенсированы увеличением Энергия вырождается в двойные < / 7 — °rbitals. И так оно и есть.、 0, QD выше, чем средняя энергия вырождения, » fe орбита 0. 4Д ниже」 вопрос вопрос Радиочастотная траектория лиганда field. In тетраэдрический комплекс (рис. 66), траектория Д-И Д — менее устойчивы.、 2? Р2-У2 * Ионы в смысле электростатического взаимодействия катионных комплексообразователей 1 И анионы лиганда.
Энергия, которая ниже орбитальной d, d, D. энергетический пробой Эй? на ZX Зависимость поля тетраэдрического лиганда показана на рисунке. 67. Различные поля симметрии обеспечивают более сложную схему деления. Значение Энергия деления, D, которая является мерой напряженности кристаллического поля、 Это зависит от свойств частиц, образующих комплекс, и симметрии поля. Расщеплять Он увеличивается с увеличением заряда комплексообразователя.
Во время перехода от комплекса Поток от Zy-металла к ad и 5 < / — металлокомплексам Лиганд увеличится на 30-80%〜чем тяжелее Ион, тем больше он будет Радиус и высокая поляризуемость. Резка получается в едином комплексе Одного и того же комплексообразователя, содержащего различные лиганды, следующее восстановление В порядке: СN — * > нет «> 9ATA > NН3> ЦНС » > Н2О — > Ф — > О — > ЦНС-> СL — > Бр-> я- Эта последовательность лигандов для создания Кристаллическое поле, которое они называют Так как это серия спектроскопической химии Он получен из спектра поглощения Сложный.
- Электронно-распределительный комплекс Устройство для обучения расщепленной энергии Низкоуровневые цели в слабых полях Общие правила и принципы: а) во-первых Изолированная перчатка Атом. Лиганды тли Диаграмма 67.Энергетический пробой Уровень D-орбитали тетраэдра поле com «Атомы, которые связаны с ядром комплекса (изомерия связи), подчеркнуты. Я Следующее наполнение самого низкого уровня; Б) Ганда; в) Паули. Но、
Сильное электрическое поле, содержащее достаточное количество электронов, полностью заполнено Низкую энергетическую орбиту, сначала 1, затем Каждая орбита (спаривание).Только после этого делают электричество Орбита ядра высокой энергии. Потому что он заставляет электроны двигаться в одну и ту же область вокруг ядра При этом сила отталкивания между ними возрастает.
Потребление энергии ESP необходимо для спаривания. Людмила Фирмаль
Значение Esp Он вычисляется методом квантовой механики и может быть определен экспериментально Мысленно из спектральных данных. Электроны против меньшего количества энергии.- По мере увеличения атомной массы Комплексообразующего агента в группе Орбиты, на которых увеличивается основное квантовое число, более диффузны. Таким образом, сила отталкивания парных электронов уменьшается.
Заселенность орбиты электронами в каждом случае зависит от Корреляция значений энергии деления и спаривания Esp. In D для ESP (Сильное электрическое поле) электроны спарены на (/^- уровне*, приводящ в、 Низкоспиновые комплексы. Наконец, если D = Esp, оба состояния (высокое и низкое то же самое относится и к cspin).Средняя энергия спаривания первого Иона Многие переходные металлы в аквакомплексе значительно превосходят их по энергии Расщепленные, т. е. они должны быть с высоким спином и парамагнитными.
Это наблюдалось на самом деле. Рассмотрим распределение радиочастотных электронов ионов Co3 +при формировании октаэдра Комплексы[CoFg] 3 „и[Co (NH3N] 3+. в изолированных ионах Co3 +внешняя Электроны расположены следующим образом: Ко * 3D 4 * 4P id Нж1н? ГТП МММ В слабом Лигандном поле F“ энергия расщепления мала: D Esp и Энергетическое преимущество только при СП3 +Ион электрон находится РФС на орбите. Поэтому комплекс [CoF6] 3 » имеет высокий спин vym, и [Co (MH3) b] 3+ — низкий spin. In кроме того, в первом комплексе、 5p3 <# — происходит гибридизация, во 2-м — <Psps. As в результате получается комплекс [CoEb] 3 ″ Парамагнитный, a [Co(NHaN] 3+ — диамагнитный.
Идея разделения, наряду с магнитными свойствами Можно объяснить с помощью сложных уровней Окраска комплексных соединений. комплексообразователь Есть электроны, которые находятся в основном состоянии на орбите(в Регулировка октаэдра).Рассказывая комплексу о количестве энергии, ответ таков Это разница в энергии между уровнями de и df, поглощенными электронами Перейти на уровень D. состояние бодрствования существует недолго, и система Вернитесь в исходное состояние.
Потому что этот процесс происходит непрерывно、 — Для октаэдрической конфигурации лиганда. Как это связано с поглощением определенного кванта энергии излучения Он поглощается избирательно. Поэтому сложные соединения окрашиваются. Эти закономерности наблюдаются, например, в водных растворах солей титана. В Партнеров TI3+.Например, один радиочастотный электрон Иона[Ti (H2O) e] 3+находится от de в ди-джее (поглощающем свет) определите фиолетовый цвет комплекса.
Итак, цвет комплекса обусловлен величиной разделенной энергии d. (См. Рисунок 65).Постепенное увеличение расщепленной энергии、 Цвет комплекса от инфракрасного до ультрафиолетового Товарищ. ТЧ качественно объясняет основные факты химии комп, а также МВС Лекс соединений: координационные числа, пространственные структуры、 Магнитные свойства, и даже оптические свойства. Однако TCH является неполным.
Основываясь на ионном предположении о связи, он хорошо объясняет Расчетные значения близки к значениям недеформируемых комплексных экспериментов. Или слегка поляризованные лиганды, то есть доля общих компонентов Небольшой в соединении. Значительная доля ковалентных связей, рассчитанная величина Характеристики комплекса не согласуются с экспериментальными данными.
ТЧ может применяться только к комплексным соединениям. Проявитель (rf элемент) имеет свободные электроны. Поэтому это не допускается Все производные нетранзитивных элементов, а также множество сравнений Лексические термины переходных металлов (Sc3+, Ti4+, Nb5+ и др.).Далее, детальная разбивка Когда центральный атом изменяется, ТЧ не учитывает структуру. Также отсутствует характеристика лигандов, или некоторые из них имеют тенденцию образовывать тг-связи.
Основная трудность ТЧ заключается в том, что она не дает частичного объяснения Ковалентная природа комплексообразователей-связывание лигандов. Поэтому все Влияние ковалентной связи на соединения в простых методах ТСХ Причина остается неизвестной. Модель ТЧ c улучшенным электростатическим взаимодействием Это действие дополняется идеей перекрытия орбит, называемой теорией лигандного поля. Дов (ТПЛ).
Успешно применяется для большого количества переходных комплексов Нормальное состояние окисления металла, где Рон Клауд не слишком большой. Дублируйте один и тот же комплекс По сути, методы ТКП и ТПЛ неуместны. Как объяснить такой комплекс Совы должны использовать ИМО. Имо, не только сложный、 Не только воспитатели, но и лиганды. Здесь комплекс рассматривается как единый Квант Механические системы, в которых отдельные атомы и молекулы теряют их Индивидуальные характеристики.
Система имеет много валентных электронов Ядро МО, покрывающее ядро комплексообразователя и все лиганды Он входит в комплекс. Движение каждого электрона、 Природа движения атомного ядра и всех других электронов. Основные результаты ТАТ был получен в рамках так называемого 1-электронного приближения. Рассмотрим октаэдрический комплекс переходного металла. Лиганд Не проявляет тенденции к образованию Т-связей. Из 6 АО лигандов 9 АО комплексообразователей происходят в 15 мес. < образование Т-связей 6 орбит подходят: d», d〜_, s, p, pp
Прямая линия между атомом металла и лигандом. Остальные 3 орбиты(d、 d, d) несвязанный, потому что электронное облако ориентировано Между лигандами энергия этих орбит существенно не изменяется. Если Используйте изображение траектории принятой в МВС и дополните его изображением Выражение постепенных орбит, схема комплексов[Co (NH3N] 3+и[CoF6] 3 ″ Он в форме. д, д, д. аху uyz Хитомуто ОМО ttz2 < [9] Z 8 ПХ Пирог. РГ ОУП С МО д, д, д. Айи аху axz \\ \ \ ОМО \ в lx2-г \ Если Т 1 2 секунды я’. ПХ Оно Пирог. Оно Оно ОУП УМК
В первом комплексе 6 электронов занимают 3 Иона Nmo Co3 +.Шесть (^»^- Лигандный электрон существует в QS, соответствующем гибридизации (По 2 штуки).И, наконец, 6 RMO диамагнитного комплекса [Co (MH3) b] 3+является вакантным. Высокий спин композит [CoFg] 3 дюйма ГВ все 3rf- Орбита будет заселена. В IMO вам не нужно использовать 4 < / — орбиты. Как электроны, подлежащие комплексированию, оседают? РМО.
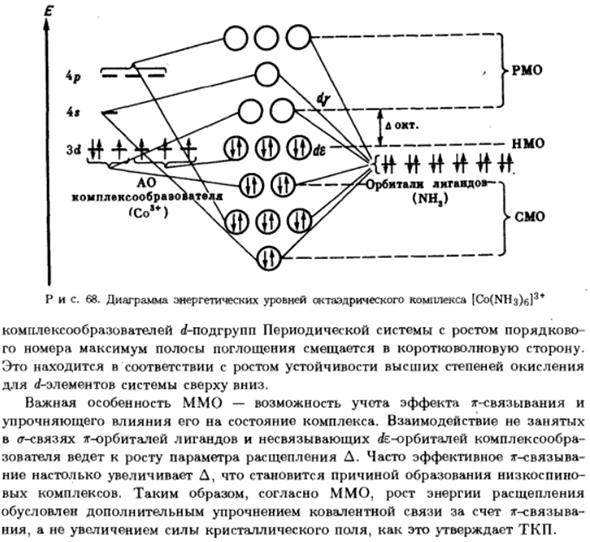
На рисунке 68 показана энергетическая схема октаэдрического комплекса Эта диаграмма объясняет магнитные и оптические свойства, и в целом Многие другие функции комплексных соединений.68, фото Как видно из рисунка Комплекс Имо гораздо более существенен, чем TCH. So, для октаэдра В комплексе Имо учитывается 15 МО, но ТЧ работает только с вкладами 5 домов (/- орбита. Rfe-TCH траектория энергетической диаграммы IMO
Соответствует вырожденному NMO в 3 веса,^ 7 — °вырождается до Риттала −2 раза РМО. В ИМО разделение энергии-это、 Ковалентные связи и перекрывающиеся орбиты центральных атомов и лигандов. Чем больше перекрытие электронного облака, тем больше значение энергии Д. Как с раздельным ТСН, распределении электронов в ИМО Орбитальные de и dy рассматриваются в соответствии с соотношением энергии Расщепление и спаривание.
Энергия связи может быть оценена на основе величины Энергия электронной десорбции энергии и соответствующего QS. Получения энергии Например, для [Co (MH3) b], как и в первом случае, он на 3+выше, чем для[CoFe] 3 QS содержит 12 нецензурных электронов, 2-й-только 10. Когда электрон, поглощающий квант света, переходит с уровня rfe на уровень df, он генерируется Полоса поглощения называется спектром TCH d-rf. Передача спектра Заряд ИМО интерпретируется как результат поглощения световой энергии、
Связанные с переносом электрона от СМО в НМО локализованы на лигандах Или комплексообразователь RMA. Эти полосы, как правило,、 Это фиолетовая часть спектра и характеризуется высокой прочностью. Для Комплексообразователь для радиочастотных подгрупп периодических систем с возрастающим порядком Первое число полос поглощения смещает максимум в сторону короткой длины волны. Это согласуется с более высоким повышением стабильности состояния окисления. Сверху вниз по отношению к элементу d системы.
Важной особенностью ИМО является возможность учета эффекта связывания тг. Усиливающее воздействие на состояние комплекса. Напряженного взаимодействия G-связывание TG-траекторий лигандов и несвязанных rfe-траекторий сложных изображений Вызывающий абонент приведет к увеличению параметра disconnect D. эффективная привязка tg во многих случаях D становится очень большим, что вызывает образование талии Вышел комплекс. Таким образом, согласно ИМО, увеличение энергии в подразделении tg-bond-для укрепления ковалентных связей Как утверждает ТКП, не увеличение напряженности кристаллического поля, а увеличение.
Смотрите также:
| Изомерия комплексных соединений\ | Понятие о химической термодинамике |
| Трансвлияние | Экзо- и эндотермические реакции. Основы термохимии |
