Оглавление:




Водородная связь
- Водородная связь. Средний символ Между валентными и межмолекулярными взаимодействиями Он имеет так называемую водородную связь. Это делается в то время как он положительно поляризован Химически связанные атомы водорода 1 отрицательно поляризованная молекула- Атом фтора, кислород и азот (реже хлор、 Сера, принадлежащая другому (или тому же самому) и т.) Диаграмма 60.
- Зависимость энергии молекулы. Такие взаимодействия являются Межмолекулярное взаимодействие-найдено в других атомах、 Расстояние * уникальные свойства поляризованных атомов 160 ′. Водород-его малый размер и отсутствие внутренних электронных слоев. Bh показывает пример образования водородных связей (пунктирные линии): нс / О \ с-н- О о-о Н-МВ НХ-Н \ 0L07nm 0.163 Нм / г О н Например, Сравнение длин связей муравьиной кислоты、 Ковалентная связь инициирующей молекулы мономера деформируется.
Ее длина С 0,097 Нм мономера до 0,107 Нм димера увеличивается. Людмила Фирмаль
Энергия-водород Соединение небольшое и находится в диапазоне от 8 до 80 кДж / mol. So, энергия водорода Бонд Х… F — 82, ч… 0-21, сек… N-8 кДж / моль. Водородные связи Чем она сильнее, тем относительная электроотрицательность будет больше и меньше Размер атома-партнера. Поэтому он легко встречается в неметаллических атомах Элементы 2-го периода системы, и в меньшей степени, характеристики хлора Серный.
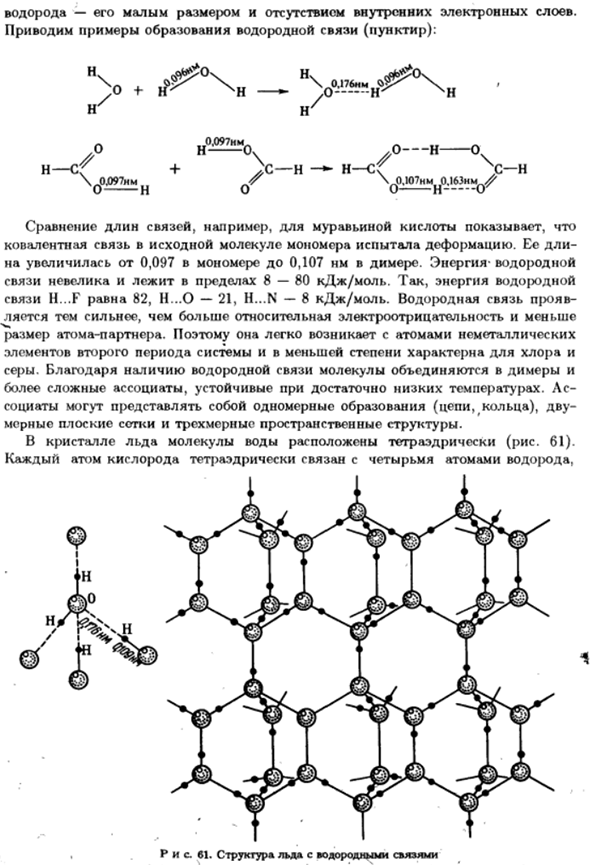
Благодаря наличию водородных связей молекула связывается с димером、 Более сложные компаньоны, устойчивые при достаточно низких температурах. Пт Общество может быть одномерным образованием (цепи, кольца), двумерным 3D пространственная структура с плоской сеткой размеров. В кристаллах льда молекулы воды расположены на тетраэдр (рис. 61).
Каждый атом кислорода связывается с 4 атомами водорода в тетраэдре、 Диаграмма 61.Структура льда с водородными связями Сто один Я Кроме того, 2 из них-полярные ковалентные связи (d _ ^ = 0,109 Нм), а Остальные 2-водородные связи(d _ = 0,176 Нм). по порядку Н-О Каждый атом водорода соединяется одновременно с 2 атомами кислорода. Это ковалентная связь, а от другой-водородная связь. Создается структура водяного знака.
- Тур, далекий от плотной упаковки. При таянии льда часто образуются водородные связи Незначительно разрушен (около 15%).Благодаря этому молекулы соединяются, вода Это плотнее, чем ice. At такое же время как обжатие структуры во время топления、 Набухание воды. Результатом суперпозиции обоих процессов является Необычный ход изменений плотности воды: наличие максимальной плотности 4°C когда вода войдет в состояние пара, весь водород будет разрушен Нью-Йорк communication.
In пара плавиковой кислоты и некоторые карбоновые кислоты, водород Связь поддерживается. Способность связывать аммиак, спирт, перекись водорода、 Гидразин, серная кислота и многие другие вещества. Поэтому, улетучиваемость уместной жидкости анормально мала, и выкостность Кости, диэлектрические константы, теплота испарения, температура кипения НИА растет ненормально. Ассоциация приводит к изменению растворителя Ability.
Многие физические свойства Вещества с водородными связями отклоняются от общего хода изменения ряда Аналог. Людмила Фирмаль
In во многих случаях возможность растворения вещества связана со способом- Он образует водородные связи. Помимо межмолекулярных водородных связей, существуют внутримолекулярные Коммуникация широко распространена и оказывает огромное влияние О химических и физических свойствах вещества. Ниже приведены примеры внутреннего образования. Молекулярные водородные связи: Салициловая кислота Альдегид Обычно водород входит в плоское 6-или 5-членное кольцо.
Сложность квантово-механического расчета водородных связей、 Что погрешность расчета намного больше энергии этой связи. По-видимому, вы можете ожидать самых надежных результатов от IMO. Расчет Для ионов ВЧ, произведено 3 3 центральных молекулярных орбиталей: директор по маркетингу, ПМО、 ЭЦЕЛЬ.2 пары электронов первоначально помещенные на орбиту фтора и водорода、 Он находится на QS и HMO и образует 2 эквивалентные связи H-F:- РМО Ф М ф-2П АО ЭЦЕЛЬ СМО Вч、 Для N АО 102.
Водородные связи играют важную роль в неорганических и органических соединениях. Химия. Его универсальность связана с распространением воды в природе. Соединения с O-H связями. Низкая энергия выпуска облигаций водопода, способность Он легко разлагается и восстанавливается при комнатной температуре. Распространенность водородной связи в биологии Логично system.
An упорядоченный массив полипептидных цепей Структура белка, сшивка двойной спирали со структурой целлюлозы Дезоксирибонуклеиновая кислота (ДНК) из-за присутствия водорода) Communication. In кроме того, доказано образование водородных связей на определенных стадиях. Почти все биохимические процессы.
Смотрите также:
| Химическая связь в твердых неорганических веществах | Комплексные соединения. Координационная теория Вернера |
| Силы Ван-дер-Ваальса | Номенклатура комплексных соединений |
