Оглавление:
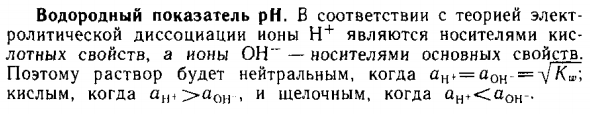


Водородный показатель pH
- РН водорода. Согласно теории электричества В случае диссоциации растворения ион H ‘*’ является кислотным носителем Твердые свойства и ОО «Ионно-основные свойства носителя». Таким образом, если ij ^ = aoc- = lr (^], решение является нейтральным. ^^^^^ кислый для ^ 7 (ин ~ 10 моль / л) -щелочь.
- Значение рН 7 совместим с нейтральными растворами только при 295 К. (22 ° С). При изменении температуры меняется Kui (см. С.164) Концентрация ионов H в нейтральном растворе. Так что при 353 К / ((£, = 25,1 • 10 «и активность ионов в нейтральном растворе Балансовая стоимость составляет ac) = 5 * 10 » моль / л и pH 6,3.
Далее Процесс рассматривается в основном при 295 температурах. 298К. Людмила Фирмаль
- В этих условиях pH нейтрального раствора равен Близко к 7.0. Из известного значения ак согласно уравнению (VI.17a) Ионная активность Н ‘^’ ОО ““ Рассчитывает активность ионов. aon = K- ^ / a ^ v. (V I.19) Показатели водорода важны для понимания. Поскольку большинство процессов происходят в жидкой фазе, Как непосредственно участвуют ионы H «^ и ОН» Эти процессы.
Кроме того, эти ионы являются однородными. Много катализаторов реакции. PH может быть доставлен Критерии кислотной или базовой прочности. В кислотной серии больше Сильный при той же молярной концентрации Высокая ионная активность и «*» (низкий pH). Следовательно, рН 0,1 М расы Раствор уксусной кислоты и раствор соляной кислоты составят 2,87 и 1,088 соответственно Характер.
Фактически, по причинам, эта зависимость полностью изменена. Людмила Фирмаль
Смотрите также:
| Активность электролитов в водных растворах | Кислотно-основные индикаторы |
| Ионное произведение воды | Произведение растворимости |
