Оглавление:



Активность электролитов в водных растворах
- Активность электролита в водном растворе. Как закон Применять закон идеальных решений Действия вводятся в фактическую систему. Метод расчета коэффициента активности у по эксперименту Из ментальных данных [см. Уравнение (V I.8)] Залейте только средний коэффициент активности электроэнергии Лит.
- В настоящее время нет экспериментального метода. Определение коэффициента радиоактивности отдельных ионов. Эти значения обычно рассчитываются по мере необходимости, Что представляет собой средний коэффициент активности электролита Среднее геометрическое значение коэффициента активности Этот ион. Следовательно, электролит A „W (V I.13) Например, для решения КС1 Y ± = V yk * Vc; Решение L12 (304) с = .
Активный фактор зависит от природы растворителя. Людмила Фирмаль
Из растворенного вещества, концентрации раствора и Температура (вкладка V I.2), Таблица Vi.2, Коэффициенты активности нескольких электролитов в растворе Как видно из таблицы, максимум составляет 298 К. V I.2, факторы активности разные В очень широком диапазоне, в области разбавленных растворов Они имеют тенденцию объединяться, Централизованное решение для охвата десятков единиц И сотни.
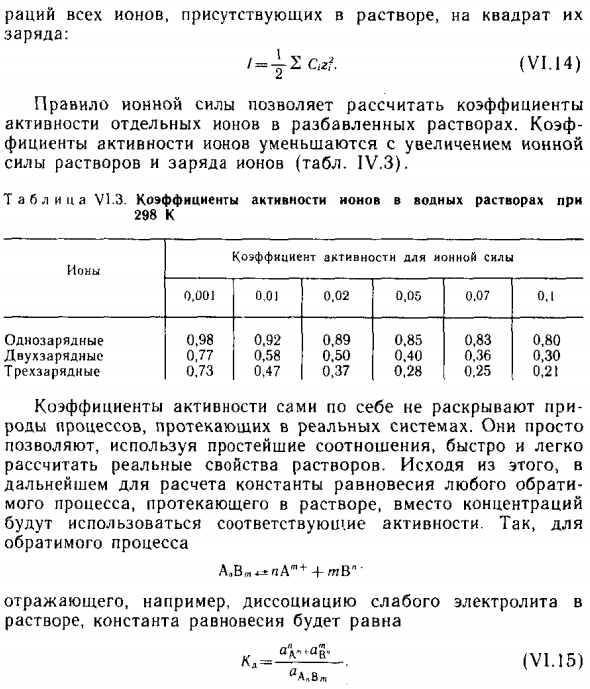
Площадь разбавленного раствора (менее 0,1 моль / л) Факторы активности в основном зависят от концентрации Заряд ионов присутствует в рации и растворе и мало зависит Это естественно растворенные вещества. Этот шаблон Известна теория решений под названием «Ионное правило» Прочность. Согласно этому правилу, ионы с одинаковым зарядом.
- Независимо от природы разбавленных растворов с одинаковыми свойствами. Ионная сила имеет такой же коэффициент активности. А про н S и l для решения называются полумесяцами концентрированных артефактов. Излучение всех ионов, присутствующих в растворе, на квадрат цены: (V I.14).
Коэффициенты могут быть рассчитаны по правилам ионной силы Активность отдельных ионов в разбавленном растворе. Корф Ионный активный фактор уменьшается с увеличением иона Сила раствора и ионный заряд (Таблица 1U.Z). Коэффициент активности ионов в водном растворе T a b l c au T T Z 298 K один фактор активности Тип процесса, который происходит в реальной системе.
Они просто Разрешить быстро и легко, используя простейшее соотношение Рассчитать фактические свойства решения. Людмила Фирмаль
Исходя из этого, Рассчитайте любую константу равновесия Процесс, который происходит в растворе вместо концентрации Соответствующие мероприятия используются. так Обратимый процесс «Вет т б» Отражая, например, слабую диссоциацию электролита Решение и константа равновесия равны C = — (V I.15
Смотрите также:
| Слабые электролиты. Константа диссоциации | Ионное произведение воды |
| Сильные электролиты | Водородный показатель pH |
