Оглавление:





Задачи по кондуктометрии
- Задача I. Кислород количественно превращался в COg в гравиметрической части органических соединений весом t g. Диоксид углерода растворяли в электролизере, заполненном разбавленным раствором. L Сниженная электропроводность оперативной щелочи и определяемого Ax * -коагуляционного раствора.
- Контрольный материал, содержащий 200-1000 мкг кислорода, подвергали такой же конверсии и измеряли соответствующее значение Dx. Содержание кислорода в образце. мкг …. 200 400 600 800 1000 лк «10 *. см 80 150 220 285 355 355 Создайте калибровочный график и рассчитайте массовую долю (%) кислорода в органическом соединении по следующим данным: Вариант 1 2 3 т, мг 2,299 2,161 2,091 4x-U6. Часы ‘300 210 260 Ответы: 1) 36,10%; 2) 26,84%; 3) 34,43%.
Результаты измерений приведены ниже. Людмила Фирмаль
2. Часть массы мг органического соединения сжигали в потоке кислорода. Воду замораживали газообразным продуктом пиролиза, и диоксид углерода направляли в ячейку, в которой измеряли электропроводность, содержащую раствор Ba (OH> 2). Сопротивление раствора в ячейке до и после эксперимента изменялось на DRx.
Это было При аналогичных условиях стандарт, содержащий 200-1000 мкг углерода, сжигает и L /? Значение также было измерено. Результаты измерений приведены ниже. Содержание углерода в образце. мкг200 400 600 800 1000 \ R-10-6, ом 80 150 220 285 355 Создайте калибровочный график и рассчитайте массовую долю (%) углерода в органическом соединении по следующим данным:
Вариант 1 2 3 т, мг 1,221 0,9982 0 9919 \ Rx-W-6, OM. 90 115 250 Ответ: 1) 16,38%; 2) 30,05%; 3) 70,57%. 3. Взвешенную часть органического соединения массой мг подвергали пиролизу при условии, что сера в веществе переходила в сероводород. После хроматографического разделения цианида газообразные продукты разложения направляли в ячейку для измерения электропроводности, содержащую раствор нитрата ртути.
Результирующее сопротивление раствора в ячейке составляет A /? * Увеличение. Reference Контрольный материал с известным содержанием серы подвергали такой же конверсии и измеряли соответствующее значение AR. Результаты измерений приведены ниже. Содержание серы в пробе, мг 0,240 0,260 0,280 0,300 Р. 450 см 5 5 5 540
- Создайте калибровочный график и рассчитайте массовую долю (%) серы в органических соединениях по следующим данным: Вариант 12 3 4 т. мг 1.315 2.158 2.129 2.354 Д /? „430 460 480 494 см Ответ: 1) 17,34%; 2) 11,49%; 3) 12,21%; 4) 11,47%. 4. При титровании 50,00 мл смеси NaOH и NH3, 0,0100 М HCl получили следующие данные. V (HCl), мл. , х, см, раствор 1. Для х, см, решение 2. x См. Решение 3. Y (HCl), мл х. Для решения 1 x см. О решении 2.
Для х, см, решение 3. Создайте кривую титрования и рассчитайте концентрацию NaOH и NH3 (г / л) в исследуемом растворе. Ответ: 1) 0,02800 г / л NaOH; 0,01363 г / л NH3; 2) 0,02400 г / л NaOH; 0,01669 г / л NH3; 3) 0,04000 г / л NaOH; 0,008852 г / л NH3. 5. Анализируемую смесь HCl и CH3COOH помещали в мерную колбу на 50,00 мл и маркировали водой.
Титрование 10,00 мл 0,1 М раствора NaOH (k = 1,104) дало следующие результаты: V (NaOH), мл. Людмила Фирмаль
7,00 8,00 9,00 10,00 11,00 х, см, раствор 1 2,50 2,20 1,90 1,93 1,96 х, см, для решения 2 2,62 2,35 2,08 1,96 2,00 2,66 2,39 2,12 2,02 2,0 для x, см, 3 решения продолжение V (NaOH), мл 12,00 13,00 14,00 15,00 16,00 х, см. решение 1 2,00 2,20 2,50 2,85 3,20 x3 для Cm, 2 решение 2,03 2,06 2,38 2,74 3,10 2,08 2,11 2,25 2,60 2,96 для решения x3
Создайте кривую титрования и определите массу NS! И CH3COOH (г) в исходном растворе. Ответ: 1) 0,1812 г HCl; 0,1160 г CH3COOH; 2) 0,1912 г HCl; 0,1210 г CH3COOH; 3) 0,1902 г HCl; 0,1376 г CH3COOH. 6. Образец смеси слабых оснований с массой мг растворяли в уксусном ангидриде и титровали с помощью измерителя проводимости.
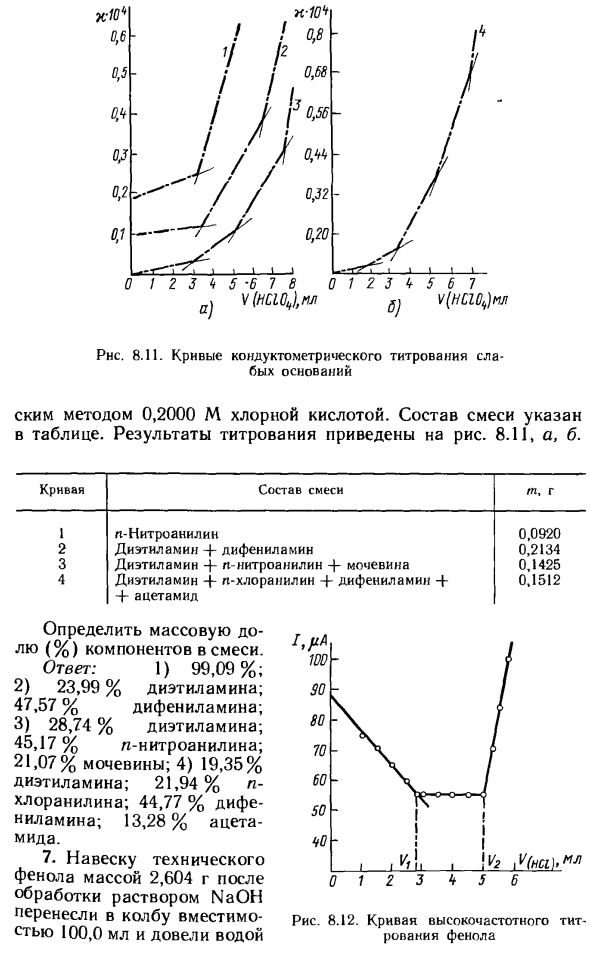
0 1,00 2,00 3,00 4,00 5,00 6,30 5,41 4,52 3,62 3,71 4,79 5,68 4,46 3,20-3,00 3,84 6,60 5,98 5,30 4,68 4,05- 6,00 7,00 8,00 9,00 10,00 5,85 6,93 9,00 12,08 15,13 4.68 5.50 7.00 10.80 14.50 4,45 5,70 7,80 12,02 16,20 ! ! 0,8 ‘/ 12 / ИК Я » 1 Дж.Дж. 0.56 / с О / м 0,32 0,20 Кю * 0,6 0,5 Ох * V 0.2 0,1 / «/ / 1 В / / / / / ■ ^ 1_1_L 0/2 3 4 5 ‘6 7 8 0 1 2 3 k 5 b 7 V (HC10J, M 6J VlHClOJtui Phc. 8,11. Кривая проводимости и твердое базовое титрование J_1_J-1-L J-J
Метод с использованием 0,2000 М хлорной кислоты. Состав смеси приведен в таблице. Результаты титрования показаны на рисунке. 8.11, а, б. Кривая состав смеси гп и г 1 L-нитроанилин 0,0920 2 Диэтиламин дифениламин 0,2134 3 диэтиламин + н-нитроанилин + мочевина 0,1425 4 Диэтиламин + кт-хлоранилин + + -дифениламин 0,1512 ацетамид
Определите массовую долю (%) компонентов в смеси. Ответ: 1) 99,09%; 2) 23,99% диэтиламина, 47,57% дифениламина; 3) 28,74% диэтиламина, 45,17% изо-нитроанилина, 21,07% мочевины, 4) 19,35% диэтиламина, 21,94% п-хлоранилина, 44,77% дифениламина, 13,28% ацетона 7. Порцию 2,604 г промышленного фенола, взвешенного после обработки раствором NaOH, переносили в мерную колбу объемом 100,0 мл и добавляли воду.
Рисунок 8.12. Кривая высокочастотного фенольного титрования Для отметки. Высокочастотное титрование образца, содержащего 0,1180 М HCl в объеме 1,00 мл, дало следующие результаты (рис. 8.12). Если V \ — объем раствора HCl при нейтрализации свободной щелочи, рассчитывают массовую долю фенола в образце (%). Ответ: 93,82%.
Смотрите также:
Решение задач по аналитической химии
| Практическое применение кондуктометрии | Электродный потенциал |
| Общая характеристика кондуктометрического метода | Схема установки для потенциометрических измерений |
